愛知県心身障害者コロニー
発達障害研究所年報 No.2
第25号
3.周生期学部
研究の概況
大平敦彦
周生期学部は、脳の複雑な構造を形成する仕組みや神秘的ともいえる機能を維持する機構を明らかにし、その成果を脳障害の予防と治療に生かすことを、おもな業務としている。周生期とは、ヒトの一生のうちで、出生前後の比較的短い時期をさす。この時期に、脳では、まず神経細胞の配置が決まる。配置の決定した神経細胞は、次に長い神経細胞を伸ばして遠くにある神経細胞と連絡を取るようになる。即ち、脳は、神経細胞間のインターネットとも言うべき神経回路網を形成し、からだの総司令部としての活動を始める。神経回路網の形成過程は、きわめて繊細で緻密な機構によって調節されていると思われ、それだけに様々な外的内的要因によって影響を受け易いであろう。周生期の中枢神経系が、呼吸障害・虚血・黄疸などによって、形態的・機能的に不可逆的な障害を受け易いのは、このような理由によるものと思われる。
脳の神経回路網が形成される仕組みを分子レベルで明らかにすることは、脳障害の成立を予防したり、その治療法を開発するうえで、不可欠である。周生期学部では、神経回路網の構築に関与する分子として、細胞間隙や細胞表面に存在し、細胞認識や細胞形態を調節していると考えられている糖タンパク、特にプロテオグリカンに注目して研究を進めている。また、神経細胞の生存や分化を調節する神経栄養因子と総称される物質群についての研究も進行している。
プロテオグリカンとは、グリコサミノグリカンと呼ばれる硫酸化多糖を結合したタンパク質の総称である。近年、中枢神経系のプロテオグリカン研究は国際的にも非常に活発になってきた。本学部も、発達期のラット脳から新しい脳特異的コンドロイチン硫酸プロテオグリカン、ニューログリカンC(NGC)を発見するなど、この研究分野の発展に貢献してきた。NGCに関する本年度のおもな成果は、ヒトNGC遺伝子のクローニングと染色体座の決定に成功したことである。これにより、病因不明とされている多くの遺伝性精神・神経疾患のなかから、NGC遺伝子の異常が原因である疾患が発見される可能性がある。現在、コロニー中央病院の医師と共同で、NGC遺伝子に変異の可能性がある症例について。遺伝子解析の準備を整えている。学習・記憶・行動など高次脳機能の発現におけるNGCの役割を明らかにするための研究も、着実に進行している。神経活動に依存したNGCの発現調節機構の解明とNGC遺伝子に異常のある遺伝病マウスの作製を目的として、マウスNGCのcDNAとゲノムのクローニングを開始した。また、脳内にNGCを過剰発現させるためのトランスジェニックマウスの作製では、ラットNGCの遺伝子が マウスに導入されたことを確認した。
脳の代表的な可溶性コンドロイチン硫酸プロテオグリカンであるニューロカンの研究では、2つの注目すべき成果をあげた。ニューロカンは、成熟脳では中央付近で切断された2つのプロテオグリカン断片として存在する。第1の成果は、そのN末端側断片が、特定の神経細胞を包むグリア性細胞突起の細胞質に存在することを明らかにしたことである。神経細胞が分泌していると考えられているニューロカンが、しかもそのN末端側断片のみが、なぜ、またどのように、グリア細胞の中に移行するのかは、今後の重要な研究課題である。第2の成果は、成熟大脳皮質に傷が付いたとき、傷周辺に幼若脳型ニューロカンが一過性に出現することを見つけたことである。ニューロカンの発現を人為的に調節することが、脳の損傷修復を促進するためのひとつの鍵となる可能性がでてきた。
小脳は、層構造が明瞭であることと存在する細胞の種類が少ないことから、神経回路形成の機構を研究する際、良い実験系となる。周生期学部でも小脳を材料として、細胞移動やシナプス形成の機構を研究している。本年度は、多動が阻害された顆粒細胞でも苔状線維とシナプスを形成することが可能であることを見つけた。このことから、顆粒細胞の移動は、必ずしも細胞分化の必要条件ではないと思われる。また、シナプス形成期のプルキンエ細胞表面に一過性に検出される糖タンパクの単離実験では、数年来の試行錯誤の結果、ほぼその精製法を確立することができた。今後、その構造やシナプス形成における役割の解明が期待される。
脳障害の予防や治療を考える時、神経細胞の生存を支持し、分化を促進する神経栄養因子の研究は、極めて重要である。昨年度までに、ニューロトロフィンファミリーに属する3つの神経栄養因子、すなわち、神経成長因子(NGF)、ニューロトロフィン-3(NT-3)、および脳由来神経栄養因子(BDNF)の高感度酵素免疫測定系を確立した。本年度は、ラット脳の生後発達におけるBDNFの変動、およびマウス脳の加齢に伴う3つの神経栄養因子の変化を明らかにした。また、免疫組織化学により、BDNFが、少なくとも30日齢ラットの海馬歯状回の顆粒細胞においては、核に顆粒状に局在しているという、興味深い知見を得た。この知見は、BDNFはすべて膜画分に回収されるという生化学的研究結果とも矛盾しない。これまで、BDNFは可溶性タンパクとして細胞外から受容体 Trk B を介して情報を伝達すると考えられてきたが、この概念で、今回の結果を説明することは難しい。BDNFには、まだ知られていない別の機能があるようだ。
青野幸子主任研究員は、米国ケイスウェスタンリザーブ大学遺伝学部における2年半の共同研究を終え、平成8年11月に帰国した。神経細胞接着分子(NCAM)の機能を、遺伝子ターゲッティングという選択技術を用いて、個体レベルで解明するための研究に従事してきた。現在、海外派遣中に習得した知識と技術を生かし、周生期学部の研究のさらなる進展に貢献している。また、大阪大学理学研究科博士課程大学院生の安田陽子は、本年度も意欲的な研究活動を展開してきた。研究所として、大学院生や博士特別研究員を受け入れる制度を整備することが、研究活性化のためのひとつの有効な手段となると考える。
今年度は、文部省科学研究費6件(重点領域研究、1件;総合研究B、1件;基盤研究A-1,1件;基盤研究B、1件;基盤研究C、2件)および厚生省精神・神経疾患研究委託費1件の援助を受けた。
ヒトニューログリカンCの遺伝子クローニングと染色体座の決定
安田陽子1、時田義人、青野幸子、松井ふみ子、小野教夫2、孫田信一2、大平敦彦
本研究室において、ラットより新たに同定された脳特異的コンドロイチン硫酸プロテオグリカン、ニューログリカンC(NGC)のヒトホモログのcDNAクローニングを行った。その結果、ラットとヒトとで塩基配列とアミノ酸配列のいずれにおいても80%以上の高い相同性を示した。また、塩基配列から推測されたラットNGCコアタンパクの特徴的な5つのドメイン、すなわちコンドロイチン硫酸鎖を結合する細胞外ドメイン、塩基性アミノ酸のクラスター、全システイン残基を含むドメイン、膜貫通ドメイン、細胞内ドメインはヒトでも保存されていた。さらに、細胞内ドメインのCキナーゼによるリン酸化部位も、両者で完全に保存されていた。また、ラットNGCのリコンビナントコアタンパクを抗原として、ポリクローナル抗体を作製した。その抗体を用いてウェスタンプロット解析を行ったところ、ラット以外にニワトリ、マウス、ネコ、サル、ヒトの脳のホモジュネート中に、抗体反応陽性分子が検出された。このことから、NGCは種差によらず広範囲の脊椎動物の脳に存在し、脳の発生や機能維持に何らかの普遍的な役割を担っているものと思われる。
クローニングしたヒトNGCのcDNAをプローブとして、FISH法により、NGC遺伝子の染色体上の位置決定を行ったところ、この遺伝子は第3染色体上の3p21.3に存在することが明らかとなった。この位置にマップされている原因不明の遺伝性精神/神経疾患をデーターべースで検索したところ、ソトス(Sotos)症候群(脳性巨人症)がわかった。ソトス症候群は、コロニー中央病院でも複数の症例がある。今後、中央病院の医師とも密接な連絡を取り、NGC分子がソトス症候群の病因や病態に関与している可能性を検討する予定である。
1大阪大・理、2遺伝学部
神経系に特徴的なコンドロイチン硫酸プロテオグリカンNGCの遺伝子クローニング
青野幸子、谷口雅彦1、時田義人、安田陽子2、松井ふみ子、大平敦彦
本研究室でその遺伝子(ラット)がクローニングされたニューログリカンC(NGC)は、神経系に特徴的に発現している膜貫通型コンドロイチン硫酸プロテオグリカンである。NGCは体性感覚野に特徴的な構造であるバレルが形成されるとき、その隔壁に一過性に発現することが明らかとなっている。またNGCのリコンビナントコアタンパクは、脳由来のCキナーゼにより効率よくリン酸化されることも明らかとなっている。これらのことより、NGCがバレル形成時に重要な働きをしていることが示唆されるが、その機能については現在までのところ明らかとはなっていない。
今回、NGCの発現調節を解明することを目的として、マウスのcDNAおよびゲノムのクローニングを試みた。cDNAライブラリーは2ヶ月齢マウス(C57BL/6)脳より調製した。ラットNGCのcDNAをプローブとしてスクリーニングを行ったところ、2kbから6kbの大きさのcDNAを多数得ることができた。ラットNGCのmRNAは単一でその大きさが3.1kbであることが報告されている。現在、northern blotting法を用いてマウスのmRNAの大きさを決めるとともに、自動シーケンサーによってその塩基配列を調べているところである。
ゲノムについては、129マウス由来の市販ゲノムライブラリー(Stratagene)を用い、ラットNGCのcDNAをプローブとしてスクリーニングを行った。数個のクローンが得られたので、最初にその制限酵素地図を作成した。次の段階として、ゲノムの構造を決定するためにその塩基配列を調べているところである。
1形態学部、2大阪大・理
ニューログリカンC(NGC)のトランスジェニックマウスの作成
時田義人、岡部 勝1、大平敦彦
当研究室がcDNAを単離した新規なコンドロイチン硫酸プロテオグリカン分子であるニューログリカンC(NGC)の生理的な機能を検討することを目的とし、トランスジェニックマウスの作成を進めている。
我々は、大脳皮質の体性感覚野で神経回路の機能単位を形成していると考えられているWhisker Barrelの内部において、NGCの発現が低下することを観察している。またNGCの発現量は、大脳皮質においては神経回路の形成に重要な時期である臨界期に多い。このことはNGCが感覚入力を基にした神経回路の形成に何らかの形で関わっていることを示唆している。そこでWhisker Barrelの内部に強制的にNGCを発現させたマウスを作成すれば、そのマウスの脳では触覚を含む感覚入力によって形成される神経回路形成に異常が起きるとの仮定のもとに本研究を行っている。具体的には、神経の分化と共に発現が見られる分子;Necdinのプロモーターをもちいて、神経回路の形成初期から持続的に中枢の神経細胞にNGCを発現させることを計画している。
本年度はNecdinのプロモーター領域をラットNGCのcDNAにつなげ培養細胞(NCB-20)に導入しプロモーター活性を確認した後、大阪大学微生物病研究所との共同研究によりマウス受精卵に遺伝子導入を行った。その結果、処理受精卵より67個体が得られた。それらの染色体DNAのサザンブロットによる解析を行い12個体の染色体にNGCのcDNAが挿入されていることを確認した。さらに現在、それら遺伝子導入された個体を交配させ、繁殖させている。
次年度は、得られたトランスジェニックマウスがラットのNGCを神経細胞で発現していることを生化学的に確認し、そのうえで形態学的、生理学的さらに行動学的な解析を行いNGCの機能を解明することを計画している。
1大阪大・医
大脳の神経細胞周囲網におけるニューロカンの局在
松井ふみ子、西塚雅子1、安田陽子2、時田義人、青野幸子、大平敦彦
ニューロカンは神経系に特異的に存在する分泌型コンドロイチン硫酸プロテオグリカンの一つである成熟ラット大脳においてはニューロカンは分子のほぼ中央で切断され、産生された2つの断片のうちN末端断片のみが一部の神経細胞の周囲に検出される(年報23号)。神経細胞の周囲には、シナプス、グリア細胞、細胞間基質などがあるが、それらのうちどの部位にニューロカンが存在するのかを調べるため、共焦点レーザー顕微鏡および電子顕微鏡による観察を行った。まず、シナプスに存在するのかどうかを調べるため、抗シナプトフィジン抗体と抗ニューロカン抗体との2重染色を行った。共焦点レーザー顕微鏡により観察したところ、これらの2つの抗体は細胞周囲の異なる部位を染色した。この結果から、ニューロカンはシナプスとは異なる部位に存在すると考えられる。そこで、抗ニューロカン抗体により染色した切片を電子顕微鏡により観察したところ、驚くべきことに、グリア細胞の細胞質に反応が見られた。これらの結果から、神経細胞を取り囲んでいるグリア性の神経細胞周囲網に、ニューロカンのN末端側断片が存在していると考えられる。このような細胞周囲への局在は、生後7日お よび14日のラット大脳では見られなかったが、生後29日ではわずかに検出された。成熟ラットでは頭頂から側方にかけて、大脳皮質の一部の神経細胞の周囲に検出された。このことから、大脳の成熟にともなって、特定の機能を持った神経細胞の周囲網にニューロカンが蓄積してくる可能性が考えられる。今後、ニューロカン陽性細胞の種類を同定するとともに、神経疾患等におけるニューロカン陽性細胞の動態を調べることにより、特定の神経細胞の周囲にニューロカンが蓄積することの生理的意義を探る必要がある。
1順天堂大・医、1大阪大・理
大脳皮質損傷修復過程に見られる幼若脳型ニューロカンの一過性発現増強
大平敦彦、尾関順子、松井ふみ子、安田陽子1、時田義人、青野幸子、慶野宏臣
私達の体が傷ついたとき、体内では、傷による障害を最小限に抑えるための様々な防衛機構が働き始める。この防衛機構の本態を明らかにし、それを人為的に増強する方策が確立できれば、損傷修復を促進することが可能となるはずである。
本研究の目的は、脳の損傷修復を促進する方法を開発するための第1歩として、脳損傷部周辺で起きているプロテオグリカン群の量的・質的変動を調べることである。そのため、ラット固定器を使用し、成獣ラット(SD,雄)の大脳皮質の特定の部位に傷(通常、深2.0×長5.0×巾0.8 mm)をつけた後、経時的に損傷周辺部を採取し、Western blot法により、プロテオグリカン分子種の同定と、量的変動を調べた。
昨年度の免疫組織化学的研究から、傷周辺の大脳皮質では、抗ニューロカン・モノクローナル抗体(MAb-1G2)による染色性が一過性に増強されていることが分かっている。この結果は、異なる特異性をもつ抗ニューロカン抗体(PAb-291)を用いた免疫組織化学によっても確認された。
ニューロカンは、成獣の脳内では、分子の中央付近で切断された2つのプロテオグリカン断片として存在し、全長の分子は検出されない。傷周辺の大脳皮質に一過性に増加するニューロカンが、成熟脳型か幼若脳で主に検出される全長の分子型かを調べた。損傷後2日から10日の傷周辺部には、成熟脳型分子に加えて、幼若脳型ニューロカンが検出された。また、幼若脳型分子の量は、Western blotのバンドの染色性から推定して、発達期の脳内含量に匹敵することが明らかとなった。損傷20日後の傷周辺部からは、もはや幼若脳型ニューロカンは検出されなかった。発達期の脳に多く存在するホスファカン、ニューログリカンC,N-シンデカンには、損傷に伴う著しい量的変動は認められなかった。
ニューロカンは、発達期の脳において、神経回路形成に重要な役割を果たしていることが明らかになりつつある。脳損傷部では、神経回路の変性防止や再構築に関与している可能性が考えられる。
1大阪大・理
ラット小脳顆粒細胞の分化と細胞体の移動について
慶野宏臣、尾関順子
脳内には神経細胞とその突起で構成されるきわめて複雑な神経回路が作られている。神経回路網の形成過程を解明することは精神神経疾患の病因・病態を理解し、それらを予防し治療するためにもきわめて重要な課題である。神経回路網の形成過程には多くの場合神経細胞の移動を伴っている。我々はラット小脳を使って神経回路網の形成過程を解明しようとしているが、本年は移動を停止させられた細胞が神経細胞に分化するか否かについて検討した。
小脳顆粒細胞は外顆粒層で最終分裂を終えると軸索を伸ばしてプルキンエ細胞とシナプス形成しながらバーグマングリア線維に沿って顆粒細胞層まで多動する。顆粒細胞層に達した細胞は短い樹状線維とシナプスを形成する。ラット皮下へ抗癌剤であるシトシンアラビノフラノシド(Ara-C)を投与すると、分子層内に異常な細胞層が形成された。プルキンエ細胞層からこの細胞層までの分子層の厚さはAra-C投与日によって異なり、Ara-C投与時にできている分子層の厚さにほぼ一致した。この細胞の由来を検討した結果、Ara-C投与時に分化を開始したが、まだ移動していなかった細胞であることが明らかとなった。この細胞は形態学的には顆粒細胞の特徴を持っていた。また、この細胞層では苔状線維とのシナプスが形成されていることが示唆される結果が得られた。これらのことから、この細胞はAra-C投与により、外顆粒細胞が移動することなく顆粒細胞として分化したと推測され、ラット小脳顆粒細胞では細胞体の多動は神経細胞の分化に不可欠な条件ではないと思われた。神経細胞の移動障害のある動物を使って、分化前の細胞を最終移動位置ヘ移植しそこで分化させることで、疾患治療のモデル系 として利用できる可能性がでてきた。
シナプス形成期ラットのプルキンエ細胞に出現し、UEA-I反応性糖鎖を持つタンパク質の分離
尾関順子、慶野宏臣
シナプス形成には該当ニューロンが互いに相手を認識する必要がある。この細胞認識には細胞表面に存在する糖タンパク質が大きな役割を果たしている。ラット小脳においてプルキンエ細胞と顆粒細胞とのシナプス形成が始まって間もない生後7日前後に、プルキンエ細胞がどのようなレクチンに反応するかを調べたところ、H型もしくはLewY型の血液型決定基と親和性の高いレクチン群がプルキンエ細胞と反応した。特に生後7日のプルキンエ細胞体と、生後10,15日の樹状突起にLTLやUEA-Iが強く結合した。この2種類のレクチン結合性を指標として、生後7日のプルキンエ細胞に発現するタンパク質を単離することを試みた。
LTL反応性糖タンパク質として生後7日ラット小脳膜成分よりAmophoterinおよびPeptidyl-prolyl-cis-trans isomeraseを得た。Amophoterinは培養神経細胞の突起形成時に発現することが知られており、さらに詳細な検討をおこなうために生後8日ラット小脳cDNAライブラリーから遺伝子を取り出した。しかしAmophoterinとして同定されたLTL反応性タンパクバンドは成獣でも少量発現している。したがって、生後7日のプルキンエ細胞に現われUEA-Iと反応する糖タンパク質はAmophoterinとは異なると考えられたので、UEA-I反応性タンパク質の分離を試みた。生後7日小脳膜分画にある30kDaの糖タンパク質が候補となった。その糖タンパク質はUEA-I結合性カラムと強固に結合し、L-フコースにエチレンジアミンを加えることで溶出された。分離用電気泳動装置プレップセルを利用し少数のタンパクが含まれるフラクションを得、UEA-Iと反応する糖タンパク質を含むフラクションをまとめて濃縮し、等電点電気泳動した。pI 6~7の位置にUEA-I反応性タンパク質が集まることを確認したので、その位置のゲルを切断し目的タンパクを抽出しつつある。
ラット脳の生後発達に伴う脳由来神経栄養因子の変化とその細胞内局在
仙波りつ子、竹内郁夫1、仙波禮治2、加藤兼房3
脳由来神経栄養因子(BDNF)タンパクの測定系を確立し、生後30日齢のラット脳における分布を昨年の本報で報告した。
今年度は、生後発達に伴うラット脳のBDNFタンパクの変化を調べた。BDNFタンパクはいづれの脳の部位においても生後30日齢頃まで増加した。海馬では30日齢以降も増加し、生後24ヵ月齢では、30日齢の2.5倍になっていた。一方、大脳皮質、線条体および視床下部のBDNFは、生後30日齢を過ぎると減少し、24ヵ月齢では、30日齢の40-50%であった。小脳、中隔野および嗅球では1ヵ月齢以降大きな変化は見られなかった。30日齢ラットの海馬におけるBDNFの所在を免疫組織化学的に調べると、歯状回の顆粒細胞の核に顆粒状に局在していた。BDNFの染色される細胞は海馬の顆粒細胞にもっとも多く、錐体細胞層の神経細胞にもわずかに見られた。一方、BDNF含量が海馬についで高い視床下部で神経細胞の核にBDNFが検出された。次に、BDNFの細胞内分布を調べたところ、BDNFはすべて膜画分に存在すること、その約50%が粗核画分に存在することが明らかとなった。BDNFは可溶性タンパクとして細胞外に分泌され、細胞外から受容体TrkBを介してその情報を伝達するといわれている。しかしながら、私達の結果では、BDNFのほとんどが膜画分に存在していた。これらの結果は、BDNFの機能をこれまでの概念で説 明することができないことを示している。とくに、核における局在は、BDNFに新しい機能のある可能性を示唆している。
1発生学部、2三重大、3生化学部
神経成長因子、脳由来神経栄養因子およびニューロトロフィン-3のマウス脳における加齢変化
仙波りつ子、加藤兼房1
マウス脳の神経成長因子(NGF)、脳由来神経栄養因子(BDNF)およびニューロトロフィン-3(NT-3)タンパクの加齢変化を調べた。NGFタンパクは、生後1ヵ月齢以降、海馬をはじめ測定したすべての部位で加齢とともに増加した。BDNFタンパクは海馬で増加し、嗅球では減少したが、その他の部位では加齢変化が見られなかった。一方、NT-3タンパクのレベルは、小脳で1ヵ月齢以降減少したが、その他の部位では加齢に伴う変化がなかった。アルツハイマー病患者の海馬ではBDNF mRNAの減少が報告されているが、予想に反して、海馬のNGFおよびBDNFタンパクは老齢マウスで上昇していた。NGFタンパクには可溶性タイプのNGFと膜結合型のNGFのあることを昨年の本報で報告した。可溶性のNGFと膜結合型のNGFの比をとると、海馬では、1ヵ月齢で0.22、4ヵ月齢で0.18、18ヵ月齢で0.11と加齢にともなって減少していた。NGFが受容体TrkAを介して細胞外から細胞内に情報を伝達し、神経細胞の生存、維持および分化に作用するとすれば、可溶性タイプのNGFがこの機能を担っていると考えられる。したがって、膜結合型のNGFの存在はきわめて予想外のことであり、その機能については現時点では明らかではない。しかしながら、神経細胞の生存維持に作用する可溶性タイプのNGFの減少は、可溶性のNGF量が老化と深い関わりのあることを示唆している。また、家族性アルツハイマー病患者へのNGFの脳内投与が効果的であることとも一致する。
1生化学部
VASEノックアウト・ノックインマウスの作成
青野幸子、Urs Rutishauser1
神経細胞接着分子NCAM(neural cell adhesion molecule)は、細胞間および細胞-細胞外基質間のカルシウム非依存性接着に関与する糖タンパクである。NCAMの特徴の一つは、発生に伴って変動する100種以上のアイソフォームが存在することである。これらのアイソフォームは1つの遺伝子からalternative splicingにより生成される。
代表的な挿入エクソンとして30 bpの長さを持つVASEが知られている。胎仔期および生後初期の NCAM はほとんどVASEをもたないが、成獣になると脳におけるNCAMの約50%にVASEが挿入されてくる。培養系では、VASEを持たないNCAMは神経細胞の突起伸長を促進する作用を持つが、VASEが挿入されたNCAMは突起伸長能を持たないことが報告されている。
今回、神経糸が発達するときに果たすVASEの役割を明らかにすることを目的として、VASEを完全に除去したVASEノックアウトマウスとVASEを発生初期より強制的に発現させたVASEノックインマウスを作成することを試みた。昨年度の年報で、VASEノックアウトマウス用標的ベクターの作成について報告したが、ES細胞に導入したところ細胞は全滅した。そこで、今年度新たなベクターを作成した。ノックインマウス標的ベクターの作成法は基本的にはノックアウトマウスと同じである。常にVASEが発現するように、VASEをもったNCAM cDNAを用いてエクソン7-VASE-エクソン8とつながったベクターを作成した。次の段階としてこれらのベクターをES細胞に導入する予定である。
1Case Western Reserve Univ.
研究業績
著書・総説
Sato, H.1, Aono, S., Danos, O.2, Heard, J. M.2, Koiwai, O.3 (1Shiga Univ. Med. Sci., 2Inst. Pasteur, 3Aichi Cancer Res. Inst.): Bilirubin-UDP-glucuronosyltransferase: Genetic defect of the hyperbilirubinemic Gunn rat, a model of Crigler-Najjar syndrome type I. Fujita, H. (ed.) Regulation of Heme Protein Synthesis, AlphaMed Press, pp. 117-123, 1994.
小祝 修1,青野幸子,佐藤 浩2(1愛知がんセンター,2滋賀医大):先天性黄疸-Crigler Najjar 症候群-の遺伝子解析および遺伝子治療. 最新医学,49:1040-1048, 1994.
時田義人、大平敦彦:脳特異的プロテオグリカン. 蛋白質核酸酵素、別冊 脳における情報伝達,42:567-570, 1997.
松井ふみ子,大平敦彦:神経系の発生・再生と細胞外マトリックス.医学のあゆみ 177:17-20, 1996.
松井ふみ子,大平敦彦:免疫アフィニティークロマトグラフィー:脳PGの精製.谷口直之、鈴木明身,古川清,菅原一幸(監修),細胞工学別冊グライコバイオロジー実験プロトコール.秀潤社,pp. 86-88, 1996.
大平敦彦,松井ふみ子:GAGとPGの神経突起伸長に及ぼす効果の検定法.谷口直之,鈴木明身,古川清,菅原一幸(監修),細胞工学別冊,グライコバイオロジー実験プロトコール.秀潤社,pp. 305-309, 1996.
大平敦彦:神経回路形成と脳特異プロテオグリカン特集「第31回脳のシンポジウム/神経組織の細胞接着蛋白」,神経研究の進歩,40: 952-960, 1996.
大平敦彦:実験医学別冊,Bio Science用語ライブラリー,細胞接着,「プロテオグリカン概論」pp. 43-44,「デコリン」p. 45,「ビグリカン」p. 46,「セルグリシン」p. 51, 宮坂昌之,矢原一郎(編),羊土社,1996.
安田陽子1,大平敦彦(1大阪大):実験医学別冊、Bio Science用語ライブラリー,細胞接着,「アグリカン」p. 47,「バーシカン」p. 48, 宮坂昌之,矢原一郎(編),羊土社,1996.
時田義人,大平敦彦:実験医学別冊,Bio Science用語ライブラリー、細胞接着,「パールカン」p. 49,「シンデカン」p. 50, 宮坂昌之,矢原一郎(編),羊土社,1996.
大平敦彦:実験医学別冊,Bio Science用語ライブラリー,脳神経,「プロテオグリカン」pp. 196-197, 御子柴克彦(編),羊土社,1997.
大平敦彦:分子細胞生物学辞典,「シンデカン」p. 425,「バーシカン」p. 617,村松正実,岩渕雅樹,清水孝雄,谷口維紹,広川信隆,御子柴克彦,柳田充弘,矢原一郎(編集),東京化学同人,1997.
仙波りつ子、加藤兼房:ニューロトロフィンの脳における加齢変化と老化脳における動態.生体の科学 47:594-606, 1996.
原著論文
Koiwai1, O., Nishizawa, M1, Hasada, K1., Aono, S., Adachi, Y2., Mamiya, N3., Sato H4., (1Aichi Cancer Res. Inst., 2Kinki Uinv., 3Nagoya Univ., 4Shiga Univ. Med. Sei.): Gilbert's syndrome is caused by a heterozygous missense mutation in the gene for bilirubin UDP-glucuronosyltransferase. Hum. Mol.Genet 4:1183-1186, 1995.
Koiwai, O1., Yasui, Y.1, 1Hasada, K1., Aono, S., Sato, H2., Fujikake, M3., Aoki, T4. (1Aichi Cancer Res. Inst., 2Shiga Univ. Med. Sci.,3Seirei Hosp., 4Toho Univ. Sch. Med.): Three Japanese patients with Crigler-Najjar syndrome type I carry an identical nonsense mutation in the gene for UDP-glucuronosyltransferase. Jpn. J. Human Genet. 40:253-257, 1995.
Watanabe, E.1, Kushima, Y.2, Oohira, A. (1Natl. Inst. Basic Biol., 2Seikagaku Corp.): Heparan sulfate proteoglycan associated with growing parallel fibers of granule cells in the rat cerebellar cortex. J. Brain Sci. 22:67-75, 1996.
Watanabe, E.1, Matsui, F., Keino, H., Ono, K.2, Kushima, Y.3, Noda, M.1, Oohira, A. (1Natl. Inst. Basic Biol., 2Shimane Medical Univ., 3Seikagaku Corp.): A membrane-bound heparan sulfate proteoglycan that is transiently expressed on growing axons in the rat brain. J. Neurosci. Res. 44:84-96, 1996.
Keino, H., Banno, T.1, Ozeki, J. (1Aichi Cancer Ctr. Hosp.):Tin-protoporphyrin plus photo-irradiation induces a release of arylsulfatase from lysosomes of rat hepatocytes in vitro and in vivo. Biomed. Res. 17:231-235, 1996.
Preobrazhensky, A.A.1, Oohira, A., Maier, G.2, Voronina, A.S.1, Vovk, T.S.1, Barabanov, V.M.1 (1Russian Acad. Sci., 2German Cancer Res. Ctr.):Identification of monoclonal antibody At5 as a new member of HNK-1 antibody family: The reactivity with myelin-associated glycoprotein and two brain-specific proteoglycans, phosphacan and neurocan. Neurohem. Res. 22:133-140, 1997.
Yamanaka M.1, Yamabe K,1, Saitoh, Y.1, Katoh-Semba, R., Semba, R.1 (1Mie Univ.) :Immunocytochemical localization of heme oxygenase-2 in the rat cerebellum. Nrurosci. Res 24:403-407, 1996.
Matsuda, M., Katoh-Semba, R., Kitani, H.1, Tomooka, Y.2(1Natl. Inst. Animal Health, 2Science Univ. Tokyo ): A possible role of the nestin protein in the developing central nervous system in rat embryos. Brain Res. 723:177-189. 1996.
Soeda, Y.1, Yamamoto, K.2, Adachi, Y.3, Hori, T.4, Aono, S., Koiwai, O.5, Sato, H.2 (1Meiji Co1. Oriental Med., 2Shiga Univ. Med. Sci.,3Kinki Univ. Sch. Med., 4Miyazaki Med. Col., 5Aichi Cancer Res. Inst.): A predicted homozygous case of missense mutation in Gilbert's syndrome. Lancet 346:1494, 1996.
Koiwai, O.1, Aono, S., Adachi, Y.2, Kamisako, T.2, Yasui, Y.1, Nishizawa, M.1, Sato, H.3 (1Aichi Cancer Res.Inst., 2Kinki Uinv. Sch. Med., 3Shiga Univ. Med. Sci.): Crigler-Najjar syndrome type Ⅱ is inherited both as a dominant and as a recessive trait. Hum. Mol. Genet. 5:645-647, 1996.
その他の印刷物
大平敦彦:神経の発生・再生とプロテオグリカン -神経回路形成期の脳に存在する新奇な膜結合型プロテオグリカンの同定-.平成7年度厚生省精神・神経疾患研究委託費による研究報告集 p. 139, 1996.
大平敦彦,安田陽子1,松井ふみ子,時田義人(1大阪大):大脳体性感覚野において触覚刺激に依存した発現をするプロテオグリカンの構造と機能.文部省重点領域研究「神経回路の機能発達」研究成果報告書(2)pp. 43-44, 1997.
大平敦彦:ブレインサイエンス振興財団の発足10周年を祝して.ブレインサイエンス振興財団10周年記念誌 pp. 131-133, 1997.
大平敦彦,安田陽子1,松井ふみ子,時田義人,小野教夫,孫田信一,渡辺英治2(1大阪大,2基生研):神経回路網の形成・再生とプロテオグリカン.厚生省精神・神経疾患研究委託「高次脳機能の発達異常に関する基礎的研究」平成8年度研究報告書 pp. 149-153, 1997.
学会発表
Koiwai, O.1, Aono, S., Adachi, Y.2, Kamisako, T.2, Yasui, Y.1, Nishizawa, M.1, Sato, H.3 (1Aichi Cancer Res. Inst., 2Kinki Uinv., 3Shiga Univ.): Crigler-Najjar syndrome type Ⅱ is inherited both as a dominant and as a recessive trait. Symposium: "Treatment of Crig1er-Najjar Syndrome" (New York) 1996.5.27.
Koiwai, O.1, Aono, S., Fujikake, M.2, Aoki, T.3, Sato, H.4 (1Aichi Cancer Res. Inst., 2Seirei Hosp., 3Toho Univ., 4Shiga Univ.):Japanese patients with Crigler-Najjar syndrome typeⅠcarry an identical nonsense mutation in the gene for UDP-glucuronosyltransferase. Symposium: "Treatment of Crigler-Najjar Syndrome" (New York) 1996.5.27.
Sato, H.1, Adachi, Y.2, Aono, S., Koiwai, O.3 (1Shiga Univ., 2Kinki Uinv., 3Aichi Cancer Res. Inst.): Proposed mechanism of dominant-negative mutation in Crigler-Najjar syndrome typeⅡ. Symposium: "Treatment of Crigler-Najjar Syndrome" (New York) 1996.5.27.
川野 仁1,福田哲也1,川村光毅1,大平敦彦(1慶応大):視床-皮質神経投射路形成におけるneurocanとL1の役割について -免疫組織化学的研究-.神経組織の成長・再生・移植研究会(大阪)1996.6.1.
福田哲也1,川野 仁1,大山恭司1,川村光毅1,大平敦彦,武内恒成2(1慶應大,2奈良先端科技大):ラット大脳皮質形成過程における各種神経接着分子の免疫組織化学的局在.日本神経科学大会(神戸)1996.7.11.
阿閉泰郎1,山本欣郎1,松井ふみ子,大平敦彦(1岐阜大):犬の下位聴覚系にみられるニューロカンの分布.日本字神経科学大会(神戸)1996.7.11.
西塚雅子1,新井康允1,松井ふみ子,大平敦彦(1順天堂大):ラット小脳におけるニューロカンとそのカルボキシルならびにアミノ末端側半の分子の局在の免疫組織化学による解析.日本神経科学大会(神戸)1996.7.12.
慶野宏臣:ラット小脳バーグマン繊維におけるレクチン反応性の発育に伴う変化.日本神経科学学会(神戸)1996.7.13.
仙波りつ子,加藤兼房:マウス脳における神経成長因子に対するアンドロゲンの作用:日本神経科学学会(神戸)1996.7.13.
安田陽子1,時田義人,松井ふみ子,渡辺英治2,中西康夫1,大平敦彦(1大阪大,2基生研):新奇な脳特異プロテオグリカン、ニューログリカンC(NGC)の発現様式とリン酸化.日本生化学会(札幌)1996.8.28.
西塚雅子1,新井康允1,松井ふみ子,大平敦彦(1順天堂大):ラット大脳皮質のニューロカン小分子免疫陽性構造,日本解剖学会(名古屋)1997.3.26.
仙波りつ子,竹内郁夫,仙波禮治1,加藤兼房(1三重大):脳由来神経栄養因子:ラット脳における加齢変化と局在.日本神経化学会(横浜)1996.10.2.
阿比留康弘1,西尾チカ1,仙波りつ子,畠中 寛1(1大阪大・蛋白研):高カリウム刺激によってアストロサイトから分泌される神経栄養因子活性.日本神経化学会(横浜)1996.10.2.
尾関順子,渡辺英治1,大平敦彦,慶野宏臣(1基生研):生後7日ラット小脳プルキンエ細胞に出現する糖タンパクの精製.日本動物学会(札幌)1996.9.20.
慶野宏臣,尾関順子:顆粒細胞移動期のラット小脳バ一グマングリア繊維に現われるDSL結合糖タンパク.日本動物学会(札幌)1996.9.20.
慶里宏臣,尾関順子:新生仔期に抗癌剤を投与したラット小脳のレクチン組織化学的解析.日本疾患モデル学会(東京)1996.11.22.
大平敦彦:神経回路形成と脳特異プロテオグリカン.文部省総合研究(B)「スーパ一バイオシステムの高次認識糖鎖分子による構築」公開シンポジウム(東京)1997.1.28.
Katoh-Semba, R., Takeuchi, I.K., Watanabe, M., Semba, R.1, Kato, K. (1Mie Univ.) Regional distribution and developmental changes of neurotorphin proteins in the mouse or rat brain and possible in vivo functions of neurotrophin-3 in the developmental rat brain. The Ⅸth Taniguchi Symposium (Division of Molecular and Cellular Biology), "Neurotrophins in Development and Plasticity of the Brain" (Osaka) 1997.3.11.
講演など
大平敦彦:神経回路形成と脳特異プロテオグリカン.第9回Glycomedicine Conference(東京)1996.6.14.
大平敦彦:脳の形態形成におけるプロテオグリカンの役割.愛知教育大学生命科学科(刈谷)1996.9.4.
大平敦彦:脂質性ネオプロテオグリカンの神経突起伸長に及ぼす効果 -グリコサミノグリカン機能解析の新しい試み-.文部省重点領域研究「神経回路の機能発達」班会議(千葉)1996.9.8.
大平敦彦,安田陽子1,松井ふみ子,時田義人(1大阪大):神経回路網の形成・再生とプロテオグリカン -新奇な脳特異プロテオグリカン,NGCのヒトcDNAクローニング.厚生省精神・神経疾患委託研究「高次脳機能の発達異常に関する基礎的研究」班会議(東京)1996.11.29.
仙波りつ子:脳におけるBDNFの分布と加齢変化.BDNF研究会(東京)1996.12.21
時田義人,青野幸子,安田陽子1,松井ふみ子,大平敦彦(1大阪大):ラット脳の神経回路網形成におけるプロテオグリカンの機能.文部省基盤研究「抗-細胞接着の分子機構と生理機能の解析」班会議(名古屋)1997.2.4.
学術集会主催
慶野宏臣:遺伝性脳神経疾患動物研究会(東京)1996.11.23.
地域活動
慶野宏臣:多治見市生涯学習教室(多治見市)1996.10.11~25.
慶野宏臣:多治見市高齢者健康教室(多治見市)1997.3.3.
海外活動
青野幸子:ケースウエスタン大学医学部にて細胞間物質(NCAM)遺伝子操作に関する共同研究(アメリカ)1994.5.8. - 1996.11.7.
教育活動
大平敦彦:神経科学(名古屋市立大学医学部)1996.4.1.~1997.3.31.
大平敦彦:生物化学Ⅱ(愛知教育大学総合理学)1996.4.1.~1997.3.31
.
仙波りつ子:生化学(横浜市立大学医学部)1996.4.1.~1997.3.31.
慶野宏臣:生物学(愛知県立春日井看護専門学校)1996.4.1.~1997.3.31.
4.生化学部
研究の概況
加藤兼房
平成8年度は、第一研究室研究員として上田浩が大分医科大学より着任した。主任研究員の正木茂夫は5月末より8月始めまで、英国ダンディー大学医科学研究所に再度派遣された。研究員の稲熊裕はカナダ国ラバル大学に昨年度に引き続き派遣中である。
第一研究室の概要:G蛋白質と呼ばれる三量体GTP結合蛋白質は、各種の神経伝達物質やホルモンなどによる細胞情報伝達の過程で、情報の転換や増幅をしていると考えられている。G蛋白質はα、β、γの3種類のサブユニットによって構成されており、それぞれのサブユニットにはよく似た数種類の分子種の存在が知られている。刺激が伝わるとGTPの結合したαとβγサブユニットが解離し、効果器とよばれる酵素やイオンチャンネルを活性化する。以前はαサブユニットが主役で、βγはαの濃度調節をしている程度に考えられていたが、ここ数年の研究でβγも同様に効果器に作用することが明らかになった。とくにGiと呼ばれるG蛋白質の中でも高濃度存在する蛋白質については、βγが機能の中心ではないかと考えられつつある。第一研究室ではβγの構造と機能について研究を進めており、昨年、γサブユニットの新しい仲間γ12の構造を明らかにし、このγがプロテインキナーゼCにより特異的にリン酸化されることを示した。今年度は、この点をさらに追求し、細胞や組織において、生理的条件下でリン酸化が起こることを見いだした。とくに、プロテインキナーゼCの活 性化とG蛋白質の活性化が同時に起こると強いリン酸化がみられることが明らかになった。一方、γ5とγ12は多くの細胞や組織に分布しているγサブユニットであるが、これらはグリオーマや線維芽細胞内において異なる分布、すなわち、γ5は細胞接着斑に、γ12はアクチンフィラメント上に存在していることをみいだした。これは、G蛋白質が細胞膜だけでなく、細胞骨格とも関連していることを示唆していると同時に、このようなγサブユニットの分子種による分布の違いは機能面での違いを表していると考えられる。
第二研究室の概要:熱ストレス、化学ストレス、低酸素ストレスなどのストレスに曝されると、生き残った細胞ではストレス蛋白質と称される一群の蛋白質の合成が盛んになる。ストレス蛋白質を多く持った細胞は、新たなストレスに対して耐性をしめす。ストレス蛋白質は非ストレス下の環境でも細胞内に存在し、新生蛋白質の折りたたみや移動・変性しかかった蛋白質の再折りたたみを助け、いわゆる「分子シャペロン」として機能を営む。第二研究室ではストレス蛋白質のうち、比較的低分子量(20-30kDa)のhsp27、αBクリスタリン、および当研究室で発見したp20について研究を進めている。これら3種類の蛋白質はそのアミノ酸配列に類似性が高い部分(αクリスタリンドメイン)をもち、もとは一つの蛋白質から進化してきたものと思われる。これら3種類のストレス蛋白質の合成がどのようにして促進されるのか?ストレス蛋白質はどのようにして細胞のストレス耐性をもたらしているのか?このような現象を臨床医学に応用できないか?などについて研究を行っている。今年度も昨年につづき、ストレス応答の修飾因子について研究を進めている。また、上記の3種類のストレス蛋白質は、他 のストレス蛋白質と異なり、細胞がストレスを受けると直ちにリン酸化される。hsp27のリン酸化については生化学的にはかなりわかっているが、αBクリスタリンおよびp20のリン酸化については未知の部分が多い。どの部位がリン酸化されるのか?どのようなリン酸化酵素が関与しているのか?リン酸化されることがどのような生理的意義があるのか?などの研究も世界に先駆けて進められている。
第三研究室の概要:生体は生理的に、あるいは様々な外的な影響を受けやがて死に至る。細胞が死ぬプロセスには、物理的に破壊されて死ぬ懐死と、細胞に内在するプログラムが始動して死ぬアポトーシスの2通りがあると考えられている。第三研究室は、ウイルス感染による宿主細胞のアポトーシスを主にインフルエンザウイルスを用いて解析している。インフルエンザウイルスは、社会的に非常に影響の大きいウイルスであるにも関わらず、このウイルスがどのように宿主に障害を引き起こすのか、十分に明らかになっていない。これまで、インフルエンザウイルス感染により、アポトーシスリセプターであるFasが遺伝子レベルで増加すること、その過程にある種のプロテインキナーゼが関与していることを報告してきた。現在、これらの作用機構をさらに詳細に解析している。また、これらのプロセスを人為的に修飾することにより、ウイルスによる細胞障害を抑制できるかどうか、検討している。レンズ上皮細胞は線維細胞に分化する際には長さ100倍体積1000倍にも膨張する。フィレンシンはレンズに固有な中間径フィラメントで、細胞骨格タンパク質のうち最も量が多く含まれ、線維細胞の膨張の際 に呼応した発現をすることから、そういった細胞形態変化を担う分子のひとつと考えられる。今回フィレンシンの発現制御機構を明らかにするためにフィレンシン遺伝子の発現を制御するプロモータの単離を試みた。フィレンシン遺伝子の上流の約12Kbpを含む領域を単離して、翻訳開始点の近傍の塩基配列を決定した。
今年度は以下に示す文部省科学研究費の援助を受けた:重点領域研究2件(脳細胞選択死、加藤;エイズの病態と制御、滝澤)、一般研究2件(B:加藤、B:浅野)。
G蛋白質γサブユニットγ12の細胞内および組織におけるリン酸化
森下理香、上田 浩、加藤兼房、浅野富子
蛋白質のリン酸化はその機能修飾の代表的な反応と考えられている。G蛋白質の各種γサブユニットのうち、γ12は試験管内でプロテインキナーゼC(PKC)により特異的にリン酸化されること、そのリン酸化部位はN末端のセリンであることをこれまでに示した。今回、リン酸化部位を認識する抗体を用いて、γ12を多量に含むSwiss 3T3 線維芽細胞内でのリン酸化について検討した。無血清培地で培養した細胞ではリン酸化γ12はほとんど認められないが、ウシ胎児血清、PKCの活性化剤であるホルボールエステル(PMA)、G蛋白質の活性化剤NaFで細胞を刺激するとγ12のリン酸化が認められた。また、PKC はホスホリパ一ゼCにより産生するジアシルグリセリドによリ活性化されると考えられるので、この酵素を活性化することが知られているエンドセリン、パソプレッシン、リゾホスファチジン酸(LPA)などで細胞を刺激するとγ12のリン酸化がみられた。これらの刺激によるリン酸化は、PKCの阻害剤 Ro31-8220 や PKC の down-regulation により消失することから、細胞内でも PKC によりリン酸化されていると結論できる。また、これらの刺激によるリン酸化の一部は百日咳毒素処理により消失することから、GqだけでなくGiを介する経路もPKC 活性化に関与していることが判明した。PMA によるPKC の活性化は最大に近いと考えられるが、PMA によるγ12のリン酸化は比較的わずかであった。しかし、 LPA と PMA を共存させると、相乗的にリン酸化が増加した。これらの結果から、γ12リン酸化には、PKCの活性化と同時に、G蛋白質の活性化に伴うβγのαからの遊離が必要と考えられる。
一方、無処置のラットの種々の組織に、リン酸化γ12の存在が認められ、膀胱、胃、腸管などの平滑筋で特に顕著であった。生体内の様々な刺激によって、γ12のリン酸化が常に起こっているものと考えられる。
G蛋白質γサブユニット、γ12、のアクチンフィラメントとの結合
上田浩、佐賀信介、篠原春夫2、森下理香、加藤兼房、浅野富子
これまでG蛋白質は、情報転換因子として細胞膜上で機能していると考えられてきた。しかし、最近G蛋白質のγサブユニットの1種であるγ5が細胞接着斑に多く分布していること、βγサブユニットが卵母細胞のサイトケラチン線維上に存在することなど、G蛋白質が細胞膜だけではなく種々の細胞骨格と密接に関係しながら機能しているという報告がなされている。そこで多くの培養細胞で主要なγサブユニットであるγ12の細胞内局在についてSwiss 3T3線維芽細胞、C6グリオーマ細胞を用いγ5の分布と比較検討を行った。
免疫組織化学的に観察すると、細胞接着斑付近に多く分布しているγ5の分布とは異なり、γ12の分布はファロイジンの分布と一致し細胞内でアクチンフィラメントと分布をともにしていた。一方、細胞をTritonX-100により分画し各γの分布を調べた結果、免疫組織化学的観察の結果と一致し、γ5は大部分が可溶性画分に、γ12はアクチンと同様に両画分に分布していた。さらにTritonX-100不可溶性画分からアクチンを多く含む画分を調整し解析した結果、その画分にはγ12が多く含まれ、さらにαサブユニットやβサブユニットも含まれていることが明かになった。このことからγ12は2量体もしく;ま3量体の形でアクチンフィラメントと結合していることが示唆された。また、精製した各種のβγとアクチンフィラメントとの結合能を調べた結果、βγ12は他のβγに比べ強い結合能を有することが示された。これらの結果から細胞内においてγ12の一部はアクチンフィラメントと結合して存在していることが示唆された。このような2種類のγの細胞内分布の違いは両γの機能面での違いを表わしてい ると考えられる。
1形態学部、2三重大・医
G蛋白質の各種サブユニットと結合する蛋白質の検索
浅野富子、上田 浩、森下理香、加藤兼房
G蛋白質は情報転換因子として多彩な役割を果たしていると考えられている。前述のように、G蛋白質は細胞膜だけでなく、細胞骨格や細胞内オルガネラにもその存在が認められ、当初考えられていたような細胞膜受容体からの刺激を伝達するだけでなく、別の機能もありうることが示唆されている。また、最も高濃度存在するGiファミリーの場合、最近αサブユニットよりもβγが機能を担っていることを示す報告が多くなされ、αの機能については逆にわからなくなっているのが現状である。そこで、G蛋白質の未知の機能を探るため、G蛋白質の各種サブユニットと結合する蛋白質の検索を試みた。まず、各種サブユニットの特異抗体による免疫沈降法で、PC12、C6、Swiss 3T3 細胞などを用いて検討した。おもにγサブユニットに対する抗体による免疫沈降を行ったが、いくつかの比較的高分子量の蛋白質が共沈してくるのが観察された。それらが特異的な結合なのか現在条件を変えて検討中である。
つぎに、disuccinimidyl suberateを用いて、G蛋白質と結合する分子を共有結合させるクロスリンク法で検討した。培養皿上で培養した細胞を直接クロスリンカーとインキュベーションした後、ウエスタンブロットで解析した。当然予想されていたが、G蛋白質のβとγの結合した分子が最も顕著なバンドとして出現した。また、αとγの結合したものと考えられるバンドがみられたので、各種αとγ間で選択性がみられるかどうか検討している。それ以外では、C6細胞において高分子量のβの抗体と反応するバンドと、Gi2αの抗体と反応するバンドがみられた。これらはβおよびGi2αとそれぞれ結合する分子と考えられるので、さらに解析を進めている。
クルクミン(curcumin)によるストレス誘導の促進
加藤兼房、伊東秀記、岡本慶子1、岩本郁子1
クルクミンはカレーなど黄色食品色素の主成分で、抗炎症作用、抗酸化作用・抗発癌作用がある物質として知られている。我々は、このクルクミンがストレス誘導を促進することを発見した。C6グリオーマ細胞に亜砒酸ストレス(100μM/60分)あるいは熱ストレス(42℃/30分)を負荷する際に、10-30μMのクルクミンを共存させると、hsp27、αBクリスタリンおよびhsp70の細胞内濃度の増加が著しく促進された。クルクミン単独では上記の蛋白質の増量は起きなかった。増量促進にはそれぞれのmRNA発現増加が先行することから、遺伝子発現の促進によるものと思われた。一方、ストレスによって活性化される熱ショック転写因子(HSF)のDNA(HSE)結合能は、クルクミン存在下でストレスを負荷した場合には、その結合活性が長期間持続することがわかった。クルクミンによるストレス誘導促進作用は、ラットC6グリオーマ細胞だけでなく、ラット肝細胞株BRL-3Aおよびマウス線維芽細胞Swiss 3T3でも認められた。クルクミンは各種のprotein kinaseを阻害することが知られている。また、cyclooxygenaseを阻害し、アラキドン酸カスケードの代謝を阻止することも報告されている。おそらく、アスピリンなどの薬剤によるストレス応答の促進と同じようなメカニズムによって、クリレクミンがストレス誘導を促進していると思われる。ラットにクルクミンを腹腔内投与し(20mg/kg体重)、42℃20分間の熱ストレスを負荷すると、副腎や肝でのhsp27、αBクリスタリンの誘導が促進され、培養細胞系で観察されたクルクミンによるストレス誘導促進作用は、個体レベルでのストレス応答をも促進することが分かり、ストレス応答現象の臨床医学への応用という観点から、毒性の少ないクルクミンの促進作用は注目に値する。
1共同研究科
Redox制御と低分子量ストレス蛋白質、hsp27とαBクリスタリン、のストレス応答
伊東秀記、岡本慶子1、岩本郁子1、加藤兼房
細胞を過酸化水素などに曝露して、酸化ストレスを負荷すると、ストレス蛋白質の合成が誘導される。一方酸化ストレスによるストレス誘導はジチオスレイトール(DTT)などの還元剤を投与しておくと阻止される。我々はラットC6グリオーマ細胞を使って、還元剤および酸化剤のストレス誘導に及ぼす影響を解析して以下の結果を得た。
1)高濃度(1-2mM)の還元剤(DTT、ジチオエリスリトール、2-メルカプトエタノール)がストレス負荷時に共存すると、ストレス誘導は阻止される。しかし、低濃度(30-50μM)の還元剤の共存下では、亜砒酸ストレス応答が選択的に促進された。しかし、同じ低濃度の還元剤に亜砒酸曝露直後に曝すと、ストレス誘導は阻害された。細胞中のprotein SHを測定すると、亜砒酸処理群と50μM DTT+亜砒酸処理群ではprotein SHが有意に減少しているのに対し、亜砒酸処理-つづいて50μM DTT処理群では増加していた。また、GSSG/GSHの比が亜砒酸処理群と50μM DTT+亜砒酸処理群では増加しているのに対し、亜砒酸処理-つづいて50μM DTT処理群では減少していた。すなわち亜砒酸と同時に加えたDTTは酸化ストレスの軽減には役立っていないことがわかった。おそらく亜砒酸による活性酸素発生に低濃度のDTTが触媒的にはたらいていて(redox cycling)、より大きな酸化ストレスとなり、低濃度のDTTがストレス応答を促進していると思われた。2)ジエチルマレイン酸(DM)を細胞に作用させると、細胞内のSH基が減少することが知られている。また、グルタチオン合成酵素の阻害剤であるL-buthionine-(S. R)-sulfoximide(BSO)を作用させると、細胞内GSHが減少する。細胞内での酸化状態の高進がストレス誘導にどのように影響を与えるかを知る目的で、これらの薬剤の作用を調べた。DMあるいはBSO自体はストレス蛋白質発現を誘導しなかったが、亜砒酸ストレスあるいは熱ストレス負荷時に1mMの濃度で共存させるとストレス誘導が著しく促進された。以上の結果よりストレス応答の情報伝達系は細胞内redox制御機構と密接に連関していることが明らかになった。
1共同研究科
Anisomycinによるストレス誘導の修飾
加藤兼房、伊東秀記、岡本慶子1、岩本郁子1
抗生物質のanisomycinはpuromycinと同じような機構で蛋白合成を阻害することが知られているが、その他にMAP kinaseファミリーの一つであるp38 protein kinaseを活性化することが明らかにされている。我々はこのanisomycin(AMC)がストレス応答を修飾することを見つけ、その詳細について解析している。C6細胞に、亜砒酸ストレス(100-150μM,1時間)あるいは熱ストレス(43℃、30分)を負荷する際にAMC(10μg/ml)を共存させると、その後に誘導されてくるhsp27、αBクリスタリン、およびhsp70の蓄積が完全に阻止された。AMC(10μg/ml)でC6細胞を1時間処理すると、ストレス応答阻止作用はその後24時間以上にわたって認められた。一方、puromycin(10-30μg/ml)はこのような阻止作用を持たなかった。亜砒酸ストレス負荷時に共存させるAMCの濃度を変えてみると、AMC0.1-0.3μg/mlの低濃度では、hsp27とαBクリスタリンのストレス誘導が促進されることがわかった。この低濃度のAMCによる促進作用は、熱ストレス応答でも見られ、ストレス負荷後にAMCを曝露した方が促進効果がより顕著であり、とくにαBクリスタリンの応答が促進された。しかし、hsp70の誘導はほとんど促進されなかった。この蛋白質レベルの変動は、それぞれのmRNAレベルでも観察された。また、αBクリスタリンのプロ モータにluciferase reporter geneを繋いだ遺伝子をtransfectしたC6細胞を用いて、αBクリスタリン遺伝子の転写活性が亜砒酸ストレスで促進し、低濃度のAMCを共存させると、さらに促進することがわかった。一方、亜砒酸曝露で活性化される熱ショック転写因子(HSF)のDNA(HSE)結合能は、0.1-10μg/mlのAMC共存下で著しく抑制された。以上の結果から、高濃度のAMCは、MAP kinaseファミリーの活性化を介して、HSFのリン酸化に伴う不活化を誘導し、ストレス応答を阻止し、低濃度のAMCは、HSFの活性化とは無関係に、ストレスによって活性化された低分子量hsp、とくにαBクリスタリンの転写活性を促進することが示唆されたがそのメカニズムは不明である。
1共同研究科
αBクリスタリンのリン酸化
伊東秀記、岡本慶子1、中山 洋2、礒辺俊明2、加藤兼房
confluent培養のU373MG細胞のαBクリスタリンは、1次元の等電点電気泳動後、抗αBクリスタリン抗体を用いたWestern blotを行うと、その大部分が非リン酸化型であることがわかった。この細胞に、亜砒酸ナトリウム(100μM,90min)、PMA(10-6M、90min)、オカダ酸(0.2μM,90min)、H2O2(4mM,90min)、ソルビトール(0.4M,90min)などを作用させると、等電点の低いリン酸化型のαBクリスタリンが誘導された。熱ストレス(45℃、30min)を負荷した場合には、不溶性の分画でリン酸化型のαBクリスタリンが誘導された。PMAとオカダ酸を同時に作用させると、3つの異なった等電点を持つリン酸化型のαBクリスタリンが検出された。32Pリン酸を取り込ませた細胞の解析から、αBクリスタリンのリン酸化部位はすべてSer残基で、少なくとも3ヵ月あることが予想された。細胞外からの刺激によるαBクリスタリンのリン酸化部位を決定するため、PMAとオカダ酸を同時に作用させたU373MG細胞の粗抽出液を抗αBクリスタリン抗体によって免疫沈降後、陽イオン交換クロマトグラフィーを行い、αBクリスタリンを精製し、LC-MS/MSにて解析した結果、19番目、45番目、59番目のSer残基がリン酸化されていることがわかった。これらの3カ所のリン酸化部位は、以 前に報告されているウシのレンズ中のαBクリスタリンのリン酸化部位と一致していた。それぞれのリン酸化部位に対応するリン酸化ペプチドに対する抗体を作製し、様々な処理をした細胞のαBクリスタリンを解析したところ、強弱はあるものの、リン酸化部位は19番目、45番目、59番目のSer残基であり、ストレスの種類によって違いのないことがわかった。
1共同研究科、2都立大・理
細胞周期分裂期で促進されるαBクリスタリンのリン酸化
加藤兼房、伊東秀記、岡本慶子1、河村則子1、佐賀信介2
種々のストレスによって、U373MGヒトグリオーマ細胞中のαBクリスタリン分子のセリン残基が最高3カ所(19Ser,45Ser,59Ser)リン酸化されることが明らかになった。それで、それぞれのリン酸化セリンを含むヒトαBクリスタリン配列のペプチド(p19S,p45S,p59S)を合成し、それぞれのペプチドとヘモシアニンを結合させて、ウサギに免疫して抗血清を得た。抗血清中の特異抗体、抗p19Sおよび抗p45Sは、ウシレンズより精製したリン酸化型のαB1クリスタリンを不溶化したセファロースカラムにて精製した。p59Sは、ウシαBクリスタリンと異なるアミノ酸を含みウシαB1クリスタリンと交叉反応性が低いため、p59Sペプチドのカルボキシ末端をカルボジイミドカップリング法にてEAHセファロースに結合させたものを用いて精製した。それぞれの精製抗体はリン酸化αBクリスタリンと反応することを、等電点電気泳動-ウェスタンブロットにて確認した。三種類の抗体の中で、親和性が最も高く、他の蛋白質との交叉反応性もなく特異性の高い抗p45Sを用いてimmunofluorescence法にてU373 MG細胞を染色すると、分裂期の細胞が選択的に強く染色されることを見つけた。HeLa-3S,Swiss 3T3,NIH 3T3,C6細胞などの細胞でも同様に分裂期の細胞が染色された。また、細胞周期分裂期阻害剤であるタキソールおよびコルセミドで処理した細胞では、陽性染色細胞が激増していた。培養フラスコを震盪し、遊離してくるU373 MGの分裂期細胞を集め、等電点電気泳動-ウェスタンブロット法(抗αBクリスタリン抗体による)を行うと、酸性側に現れるリン酸化αBクリスタリンのバンドが著しく増加していて、これが抗p45S抗体と反応することから、免疫組織化学的な結果が生化学的にも裏付けられた。最近、抗p45Sを用いてこの部位がリン酸化されたαBクリスタリンを特異的に測定できる系が完成したので、この系も使って、αBクリスタリンのリン酸化の生物学的意義を明らかにして行きたい。
1共同研究科、2形態学部
Two-Hybrid Systemを用いた低分子量ストレス蛋白質と相互作用する蛋白質の探索
稲熊 裕、Denis R. Joanisse1、 Sebastien Michaud1、Robert M. Tanguay1
我々は低分子量ストレス蛋白質が他のどのような蛋白質と相互作用しているかを探索することによって低分子量ストレス蛋白質が細胞の機能制御にどのように関与しているかを明らかにする試みを行った。その方法として、Two-Hybrid System(STRATAGENE社)を用い、低分子量ストレス蛋白質をbaitとしてショウジョウバエのライブラリのスクリーニングを行った。クローニングにあたってはヒスチジン栄養要求性とβ-ガラクトシダーゼ活性の発現を指標とした。得られたクローンの塩基配列を決定し、既存の配列のデータベースと比較した。また、この遺伝子を大腸菌内で発現させ、その蛋白質を精製し抗体を作製した。我々の得たクローンは種を越えて非常によく保存された蛋白質であった。ショウジョウバエでは新規のもので酵母、哺乳類のものとも非常に高いホモロジーを示した。現在以下の点について検討中である。(1)酵母変異体を用いcomplementation testによる生物学的機能の保存の確認、(2)in vitroにおける相互作用の確認、(3)蛋白質-蛋白質相互作用に関わる認識部位の決定、(4)哺乳類低分子量ストレス蛋白質との相互作用の確認、(5)細胞内分布、組織分布、雌雄あるいは発生に伴う変化、(6)in situ hybridizationによる染色体上の位置決定、(7)genomic DNAクローンの構造解析b、(8)細胞抽出液を蔗糖濃度勾配により分画し低分子量ストレス蛋白質の分布と比較。低分子量ストレス蛋白質はその一次構造が非常によく保存された蛋白質で基本的な生物学的機能に関わっていると考えられる。今回我々の得たクローンも種間でよく保存された遺伝子で基本的な生物学的機能に関与していると予想される。
1Univ. Laval
インフルエンザウイルス感染によるアポトーシス誘導機構
滝澤剛則、大橋佳代子、中西義信1
インフルエンザウイルスは、毎年多くの人に上気道感染や時に重篤な肺炎や脳炎を引き起こし、社会的影響のきわめて大きいウイルスである。しかしながら、その病原性発現機構は不明な点が多い。我々はこれまで、インフルエンザウイルス感染により宿主細胞がアポトーシスシグナル受容体であるFasの誘導を伴って死滅することを報告した。このFasの増加はmRNAレベルで起きており、さらに合成2本鎖RNA poly(I)-poly(C)によってもFas mRNAの増加が認められたことから、ウイルスの複製過程で生じると考えられる2本鎖RNAがFasを転写レベルで誘導している可能性が示唆された。一方、ヒトFas遺伝子のプロモータ領域の構造解析により、そこには転写因子NF-IL6の結合部位が少なくとも8カ所存在することがわかった。この領域をルシフェラーゼ遺伝子の上流につなぎ、プロモーター活性を検討したところ、ウイルス感染によりプロモーター活性が約2倍に増加し、その活性化に伴ってNF-IL6のDNA結合活性が量的変化を伴わずに増加することがわかった。つぎに、どのNF-IL6結合部位が転写活性増加に必要であるか検討するために、NF-IL6結合部位を順次欠失させてプロモーター活性を測定した。その結果、転写開始部位よりも下流に存在するNF-IL6結合部位が重要であることがわかったが、必須であるかどうかは結論できなかった。NF-IL6はリン酸化によって活性化されることが報告されているため、その活性化に2本鎖RNA依存性プロテインキナーゼ(PKR)の関与する可能性が考えられた。このことは、ドミナントネガティヴ変異PKRを導入した細胞では、インフルエンザウイルス感染によるFasの増加とア ポトーシス誘導がともに著しく阻害されることからも裏付けられた。現在、PKRがNF-IL6をリン酸化するかどうか検討している。
1金沢大・薬
2本鎖RNA依存性プロテインキナーゼ(PKR)のアポトーシスにおける役割の解明
滝澤剛則、大橋佳代子、中西義信1、藤井雅寛2
PKRは様々なウイルス感染によって活性化され、宿主の蛋白合成のシャットオフに関与すると考えられている。また、ある種のウイルスはPKRを抑制するメカニズムを有することが知られている。一方、PKRを細胞に過剰発現するとアポトーシスが誘導され、逆にドミナントネガティヴ変異PKRを導入するとトランスフォームすることが明らかになり、細胞増殖への関わりが示唆されている。我々は、インフルエンザウイルス感染によるアポトーシスの解析から、Fas発現増加にPKRの関与する可能性があることを報告してきた、そこで、PKRとアポトーシスとの関連性をさらに検討する目的で、下記の実験を行った。まず、これまで報告されているLys(296)をArgに置換したドミナントネガティヴ変異、およびN末端に近いdsRNA結合ドメインを欠失した変異PKRを作製し、HeLa細胞に導入した。そして、抗Fas抗体とシクロヘキシミド処理による細胞死に及ぼす影響を検討した結果、変異PKRを導入したHeLa細胞では、Fasによる細胞死が抑制されることがわかった。このことは、PKRがFasを介したアポトーシスシグナルを修飾している可能性を示唆している。次に、HTLV-1のtax発現細胞がFasに対して抵抗性を示すこと から、tax発現のPKRへの影響を調べたところ、taxを発現誘導することによりPKRの量、活性ともに減少することがわかった。現在、この分子メカニズムを明らかにするとともに、taxにより細胞がFasに対して抵抗性を示すようになる原因に、PKRがどのように関与しているか検討している。
1金沢大・薬、2東京医歯大・医学研究科
レンズ線維細胞に特異な細胞骨格タンパク質フィレンシンの遺伝子プロモータ領域の単離
正木茂夫
レンズは特異な器官として知られている。それは生体の中で唯一血管を内部に持たない器官であり、全体が透明で高い光屈折性と弾性に富み、レンズ中心部の細胞は排除されることなくその生体と同じだけの寿命を生き続ける。
レンズには幾つもの特異タンパク質が見つかっており、その機能は良く調べられている。例えばクリスタリンはレンズを透明にし光屈折性を与えているし、膜イオンチャンネルタンパク質は細胞の膜透過性を高めて血管を持たないレンズでも外部血流との物質交換を可能にしてその生理活性を維持できるようにしている。またフィレンシンは、レンズに固有な中間径フィラメントタンパク質で、レンズ上皮細胞は線維細胞に分化する時長さ100倍体積1000倍にも膨張するが、フィレンシンはそういった形態変化を担う分子のひとつと考えられている。
フィレンシンとCP49遺伝子の発現制御が、クリスタリンで見られるPax6,L-mafやSOX2などのレンズ特異発現翻訳調節因子によるのか、それとも中間径フィラメントタンパク質型の発現制御機構を持つのかを明らかにするため、フィレンシン遺伝子の発現を制御するプロモータの単離を試みた。フィレンシン遺伝子のイントロン1の断片をプローブに用いてマウスゲノムDNAライブラリのスクリーニングを行い、遺伝子上流の約12Kbpを含む領域を単離した。同時にフィレンシンmRNAの翻訳開始点をS1マッピング法によって決定した。次に翻訳開始点を含む4.5Kbpについて塩基配列を決定した。配列を「翻訳制御因子データベース」によってサーチしたところ、翻訳開始点近傍にはクリスタリン遺伝子などで見られるはっきりした「TATA-Box」はなく、幾つかの中間径フィラメント遺伝子に見られる「GC-Box」が複数観察された。また翻訳開始点のごく近傍にγ、δクリスタリン遺伝子発現に関連するとされるSOX2の結合部位に類似の構造が見られた。
研究業績
著書・総説
加藤兼房:ストレス(熱ショック)蛋白質.CLINICAL NEUROSCIENCE 14:484-485, 1996.
仙波りつ子、加藤兼房:ニューロトロフィンの脳における加齢変化と老化脳における動態、生体の科学 47:594-600, 1996.
杢野謙次、廣瀬善清、祖父江 元、加藤兼房:神経疾患マーカーとしての髄液中NSEとS-100蛋白質、最新医学 52:283-289, 1996.
滝澤剛則:ウイルスによるアポトーシスの制御機構.医学のあゆみ 177:864-868, 1996.
滝澤剛則:インフルエンザウイルス感染によるアポトーシス誘導機構.日本臨床 54:110-115, 1996.
原著論文
Hao, L. Y.1, Ueda, H. Yubisui, T.2, Takeshita, M.1 (1Oita Medical Univ., 2Kochi Univ.):Two different activities of phospholipase A2 in porcine aortic cytosol. Life Sci. 59: 1443-1454, 1996.
Oguni, M.1, Shinohara, H.2, Asano, T., Kato, K., Setogawa, T.1 (1Shimane Med. Univ., 2Mie Univ.): Ontogeny of GTP-binding proteins, Gi and Go, in rat retina. Histochem. Cell Biol. 106:235-240, 1996.
Mokuno, K.1, Kiyosawa, K1., Honda, H.1, Hirose, Y.1, Murayama, T.1, Yoneyama, S.1, Kato, K. (1Nagoya Univ.): Elevated serum levels of manganese superoxide dismutase in polymyositis and dermatomyositis. Neurology 46:1445-1447, 1996.
Yonezawa, S., Nodasaka, Y.1, Kamada, T.1, Fujita, S.C.2, Kato, K., Yamada, Y., Ogasawara, N., Shoji, R. (1Hokkaido Univ., 2Mitsubishi Kasei Inst. Life Sci.): Cochlear histopathology of the mutant bustling mouse, BUS/Idr Acta Otolaryngol.(Stockh.) 116:409-416. 1996.
Oguni, H.1, Tamura, K.1, Kato, K., Setogawa, T.1 (1Shimane Medical Univ.): Chronic retinal effects by ultraviolet irradiation, with special reference to superoxide dismutases. Histol. Histopathol. 11:695-702, 1996.
Suzuki, A.1, Kozawa, O., Oiso, Y.1, Kato, K.(1Nagoya Univ.):Protein kinase C activation inhibits stress-induced synthesis of heat shock protein 27 in osteoblast-like cells: Function of arachidonic acid. J. Cell. Biochem. 62:69-75, 1996.
Kato, K., Ito, H., Inaguma, Y., Okamoto, K., Saga, S.: Synthesis and accumulation of αB crystallin in C6 glioma cells is induced by agents that promote the disassembly of microtubules. J. Biol. Chem. 271:26989-26994, 1996.
Inaguma, Y., Hasegwa, K., Kato, K., Nishida, Y.1 (1Nagoya Univ.):cDNA cloning of a 20-kDa protein (p20) highly homologous to small heat shock proteins: developmental and physiological changes in rat hindlimb muscles. Gene 178:145-150. 1996.
Oguni, M.1, Otani, H.1, Shinohara, H.2, Kato, K., Setogawa, T.1 (1Shimane Medical Univ., 2Mie Univ.): lmmunohistochemical study of 28kD heat shock protein in the lens of young human embryos. Ophthal. Res. 28:270-274. 1996.
Takashi, M.1, Sakata, T.1, Inaguma Y., Kato, K. (1Nagoya Univ.): Elevated concentrations of γ- enolase in cell turors in rats: similarity to rena1 cell carcinoma in man. Urol. Res. 24:375-379. 1996.
Takizawa, T., Ohashi, K., Nakanishi, Y.1 (1Kanazawa Univ.): Possib1e involvement of double-stranded RNA-activated protein kinase (PKR) in the cell death by influenza virus infection. J. Virol. 70:8128-8132, 1996.
Ito, H., Okamoto, K., Kato., K.: Prostaglandins stimulate the stress-induced synthesis of hsp27 and αB crystallin. J. Cell. Physiol. 170:255-262, 1997.
Morishita, R., Saga, S., Kawamura, N., Hashizume, Y.1, Inagaki, T.2, Kato, K., Asano, T. (1Aichi Med. Univ., 2Nagoya-shi Kosein): Differentia1 localization of theγ3 and γ12 subunits of G proteins in the mammalian brain. J. Neurochem. 68:820-827, 1997.
学会発表
Kato, K., Ito, H., Inaguma, Y., Okamoto, K.: Synthesis and accumulation of αB crystallin in C6 glioma cells is induced by agents that promote the disassembly of microtubules. Cold Spring Harbor Meeting (New York) 1996.5.2.
財前行宏1、上田 浩、徳田春邦2、西野輔翼2、竹下正純1(1大分医大、2京都府医大):EBウイルス抗原発現・細胞増殖・脂肪酸の取り込みに及ぼす高度不飽和脂肪酸の効果.日本生化学会九州支部例会(北九州)1996.5.12.
浅野富子、森下理香、松田孝彦1、橋本裕一1、岡野俊行1、深田吉孝1、加藤兼房(1東京大):G蛋白質γサブユニットγ12の一次構造と性質.日本生化学会中部支部例会(名古屋)1996.5.16.
加藤兼房、稲熊 裕、伊東秀記、岡本慶子:動物細胞におけるストレス応答と修飾.日本生化学会中部支部例会シンポジウム(名古屋)1996.5.17.
加藤兼房、伊東秀記、岡本慶子:ラットグリオーマ細胞(C6)でのαBクリスタリンの合成・蓄積は微小管脱重合促進剤によって促進される。日本神経科学会(神戸)1996.7.11.
仙波りつ子、加藤兼房:マウス脳の神経成長因子に対するアンドロゲンの作用.日本神経科学会(神戸)1996.7.13.
Takizawa, T., Ohashi, K., Nakanishi, Y.1 (1Kanazawa Univ.): Mechanism of the induction of apoptosis in tissue culture cells upon influenza virus infection. 10 the International congress of virology (Jersalem) 1996.8.12.
Joannise, D.R., Inaguma, Y. Tanguay, R.M.: Insearch of intracellular partners for the small heat shock proteins of Drosophila. Second Region Northeast Meet on Stress Proteins and The Heat Shock Response, (Mississauga, Canada) 1996.8.19.
加藤兼房、伊東秀記、岡本慶子:還元剤によるαBクリスタリン、hsp27およびhsp70のストレス応答の修飾.日本生化学会(札幌)1996.8.27.
伊東秀記、岡本慶子、加藤兼房:低分子量ストレス蛋白質の早期ストレス応答:αBクリスタリンのリン酸化.日本生化学会(札幌)1996.8.27.
岡本慶子、伊東秀記、加藤兼房:C6グリオーマ細胞中のαBクリスタリンはグルココルチコイド(dexamethasone)により合成が誘導される.日本生化学会(札幌)1996.8.27.
森下理香、上田 浩、加藤兼房、浅野富子:G蛋白質γサブユニットγ12のリン酸化部位を認識する抗体とリン酸化γ12の細胞、組織での検出.日本生化学会(札幌)1996.8.27.
上田 浩、森下理香、篠原春夫1、加藤兼房、浅野富子(1三重大):G蛋白質γサブユニットγ5とγ12の異なる細胞内分布.日本生化学会(札幌)1996.8.27.
正木茂夫:ラットフィレンシン遺伝子の構造.日本生化学会(札幌)1996.8.27.
指吸俊次1、上田 浩、竹下正純2、吉田 敏2、中谷昌尚1、藤原滋樹1、川村和夫1(1高知大、2大分医大):ミサキマメイタボヤ芽体におけるトリアシルグリセロールの増加とその意義.日本生化学会(札幌)1996.8.30.
滝澤剛則、大橋佳代子、中西義信1(1金沢大):2本鎖RNA依存性プロテインキナーゼ(PKR)のFas誘導アポトーシスシグナルヘの関与の可能性.日本生化学会(札幌)1996.8.30.
Masaki, S.: Structure of rat filensin gene. XII International congress of Eye Research (Yokohama) 1996.9.30.
仙波りつ子、竹内郁夫、仙波禮治、加藤兼房:脳由来神経栄養因子:ラット脳における加齢変化と局在.日本神経化学会(横浜)1996.10.2.
伊東秀記、岡本慶子、加藤兼房:低分子量ストレス蛋白質のリン酸化.日本神経化学会(横浜)1996.10.2.
岡本慶子、伊東秀記、加藤兼房:DexamethasoneによるC6細胞中のαBクリスタリンの誘導.日本神経化学会(横浜)1996.10.2.
加藤兼房、伊東秀記、岡本慶子、佐賀信介:C6グリオーマ細胞におけるαBクリスタリンの蓄積.日本神経化学会(横浜)1996.10.2.
森下理香、佐賀信介、稲垣俊明1、加藤兼房、浅野富子(1名古屋市厚生院):脳におけるG蛋白質γサブユニットγ3とγ12の局在の加齢による濃度変化.日本神経化学会(横浜)1996.10.4.
中西義信1、滝澤剛則(1金沢大):インフルエンザウイルス感染細胞のアポトーシス誘導機構.日本ウイルス学会(静岡)1996.10.23.
伊東秀記、岡本慶子、加藤兼房:αBクリスタリンのストレス早期応答-リン酸化-.日本細胞生物学会(京都)1996.10.24.
加藤兼房、伊東秀記、岡本慶子:還元剤によるストレス応答の修飾-促進と抑制-.日本細胞生物学会(京都)1996.10.24.
上田 浩、佐賀信介、篠原春夫1、森下理香、加藤兼房、浅野富子(1三重大):三量体G蛋白質γサブユニットγ12のアクチンフィラメントとの結合について.日本細胞生物学会(京都)1996.10.25.
小澤 修1、徳田治彦2、松野浩之1、丹羽雅之1、植松俊彦1、加藤兼房:骨芽細胞MC3T3-E1細胞における低分子量ストレス蛋白質(hsp)27のストレス応答.臨床ストレス蛋白質研究会(東京)1996.11.9.
伊東秀記、岡本慶子、加藤兼房:プロスタグランジンによるストレス誘導の修飾.臨床ストレス蛋白質研究会(東京)1996.11.9.
正木茂夫:フィレンシン遺伝子の構造.水晶体研究会(湘南)1997.1.18.
講演など
滝澤剛則;ウイルス感染細胞死を制御する宿主因子-RNA依存性キナーゼの解析.文部省重点領域研究「エイズの病態と制御に関する基礎研究」斑会議(京都)1996.6.28.
滝澤剛則:ウイルス感染細胞死を制御する宿主因子-RNA依存性キナーゼの解析.文部省重点領域研究「エイズの病態と制御に関する基礎研究」斑会議(東京)1996.11.30.
加藤兼房:ストレス蛋白質の応答と機能.胸部外科リサーチフォーラム(名古屋)1996.12.6.
加藤兼房:微小管脱重合促進剤によるαBクリスタリンの発現・蓄積の誘導.文部省重点領域研究「脳細胞選択死」斑会議(東京)1996.12.13.
Katoh-Semba, R., Takeuchi, I., Watanabe, M., Semba, R.1, Kato, K. (1Mie Univ.): Regional distribution and developmental changes of neurotrofin proteins in the mouse or rat brain and possible in vivo functions of neurotrophin-3 in the developing rat brain. The Ⅸth Taniguchi Symposium Neurotrophins in development and plasticity of the brain (Osaka) 1997.3.11.
滝澤剛則:インフルエンザウイルス感染によるシステインプロテアーゼの活性化.インフルエンザ研究者交流の会シンポジウム(刈谷)1997.3.26.
その他の研究活動
学術集会主催
加藤兼房:日本生化学会中部支部例会(名古屋)1996.5.16.~5.17.
海外活動
加藤兼房:Cold Spring Harbor 会議「Molecular Chaperones & Heat Shock Response」に出席、発表(アメリカ)1996.5.1.~5.5.
滝澤剛則:第10回国際ウイルス学会に出席、発表(イスラエル)1996.8.11.~8.16.
正木茂夫:ダンディ大学医科学研究所にてマウスフィレンシン遺伝子に関する共同研究(イギリス)1996.5.29~8.2.
稲熊 裕:ラバル大学にて低分子量ストレス蛋白質の機能に関する共同研究(カナダ)1995.6.26. ~1997.6.25.
教育活動
加藤兼房:神経科学(名古屋市立大学医学部)1996.4.1.~1997.3.31.
滝澤剛則:生化学(金沢大学医学部)1996.4.1.~1997.3.31.
滝澤剛則:生化学(愛知県立春日井看護専門学校)1996.4.1.~1997.3.31.
滝澤剛則:生化学(愛知医科大学)1996.5.1.~1997.3.31.
滝澤剛則:学位審査(金沢大学大学院自然科学研究科)1997.2.4.
5.生理学部
研究の概況
伊藤宗之
脳や筋肉の細胞は興奮性膜と呼ばれる細胞膜をもち、働くとき活動電位を生ずること、分化した細胞は分裂しないなどの特長を持つ。生理学部では障害児(者)に見られる脳・神経・筋肉の病気をマウス、ラット、ネコなどの実験動物に起こさせたとき、正常と比べて細胞がどのような形をしているか、どのような動きをしているのか、一方ではこのような動物が個体全体としてはどのような振る舞いをするのか調べている。ヒトでは、実験できない総合データを分析することにより、障害の発生原因を明らかにし、進んでは治療の糸口を見つけだそうとしている。個々の部員の研究領域は常に発展、変化するので一概には言えないが、総じて第一研究室が神経、第二研究室が筋肉、第三研究室が心と脳の問題を分担している。
先ず第一研究室では浦本が運動神経の研究を行なっている。ここでは筋肉の麻痺とかけいれんに関する神経末端の化学物質の動きを、電気ポテンシャルを記録することから推測する。昨年度は、一連の電気刺激により、運動神経末端のアセチルコリンのリサイクル過程が活性化することを報告した。神経-筋システムの記憶現象としてユニークなものだった。これはネオスチグミンの投与下でたまたま明らかになったことだが、今年度は薬剤の影響とは無関係に起こりうること、また、この効果が分単位の時間経過を有し、電位の解析に変動系数を導入するとインパルス伝達の記憶の実体がさらに明らかとなった。渡部は中枢神経細胞の軸索突起が切られても、再生の可能性があることを、ネコの目の網膜を使って昨年までに明らかにしてきた。これには実験的には視神経を切断したあと、断端に末梢神経を自家移植し脳に向けて架橋すると良い。脳内のどこに向けて架橋すれば良いか。大脳皮質ともともと視神経が投射している外側膝状体に移植神経の中枢端を置いたとき最も成績が良かった。再生した視覚中枢路が機能的であることも、電気生理学的に証明できた。軸索再生中の光環境についても調べた。 視神経の再生は暗やみ中でも可能であるが、再生線維を出している網膜神経節細胞は病的であった。やはり健全な視神経再生には光が必要である。再生の第一条件は先ず切断後、神経節細胞が逆行性に死滅しないことである。犬養は架橋をせず視神経の切断だけ行なった場合の生存率を調べた。抵抗性の高い細胞のタイプほど再生に有利な訳だが、今回対象とした切断後2週間まででは大型の細胞ほどよく生き残ること、詳しくは時間・網膜の部位による違いのあることも明かとなった。
第二研究室の戸塚は全身の筋肉が萎縮していく筋ジストロフィー症のマウスを使って、顕微鏡で細胞像を日令を追って調べている。これらの標本では筋線維の中に核がある中心核筋線維が特長的だが、いままでの通説に反して、この中心核筋線維は太いことが分かった。これは中心核の活性説につながるもので、今年はさらに鳥類も導入して中心核筋線維の筋成長との関係を追及した。一方、ヒトのデュシャンヌ型筋ジストロフィー症との比較では、ヒトもマウスも「体の比重」相当の値を基準にすると発症のタイミングは一致することがわかった。渡辺は筋線維の核が機械受容器としての役割も持っていることを、筋ジストロフィー症マウスを使って電子顕微鏡的に確認した。筋核のしわや陥没が強力な証拠となったのである。化学反応への変換器も兼ね備えているとの推測がさらに裏付けを得た。佐久間は筋ジストロフィー症とストレスの関係を探るため、筋ジストロフィー症マウスで筋タイプ別に熱ショックタンパク質の含有量をイムノアッセイ法、ウェスタンブロット法、免疫組織染色法で測定した。正常マウスと比ベ速筋で特に低分子量のストレスタンパク質が著明に増量していた。当研究室では、 筋ジストロフィー症は、骨が成長してゆくなかで筋肉の成長が追い付いてゆけない場合に起こるのであると長年にわたり力説している(筋-骨不均衡説、これと裏腹な関係にある骨成長依存性筋成長障害説も提唱している)。
第三研究室で橘と岡が動物の行動奇形を調べているのが心の問題とすれば、中西がシャーレの中で見ているのは発達中の脳である。橘は妊娠中のニコチン投与の効果を見ていて、対照群と出生日を一致させて比べると解釈不能の結果が出るが、受精日を考慮して補正すれば妥当な結果がでるのに遭遇した。各国の薬事行政に影響力をもっているICHのガイドラインでは出生日を基準にすると謳っている。しかしこの基準に無批判に従うと、誤った解釈を下してしまう可能性があることになる。常に受精日を念頭に置いて、妊娠日数に影響を与える薬剤かどうか注意していなければならないと斯界に警告した。岡と橘はタッチスクリーンによる視覚弁別学習がラットでも可能かどうか研究した。答えは可能と出た。与えられた課題により非常に学習の難しいものもあり、今後は学習成否の鍵はどこにあるのか追及するが、視覚刺激の形、大きさ、色、報酬、動物の系統などの因子を一つづつ検討して行く。中西は動物の脳細胞を胎児の時に取り出して、発達とともに神経線維が延びるさまを顕微鏡下で見ながら、実際に任意の二個の神経細胞にパッチ電極を刺入し、膜電位が同期してバースト放電するのを確認し た。次いで色素の細胞内注入でギャップ結合の可能性の有無を検証したが、むしろシナプス連絡によるバースト放電である可能性が高いという結果が得られた。この染色により、一個のニューロンの神経突起の広がる範囲を計ったところ、半径200ミクロンの範囲に及んでいた。ニューロン間の同期バーストはネットワーク形成の初期段階として不可欠と考えられるので、脳発達障害の機序との関わりを探るよい実験系になりうることがわかった。
リサイクル過程の短期記憶的調節と連続刺激
浦本 勲
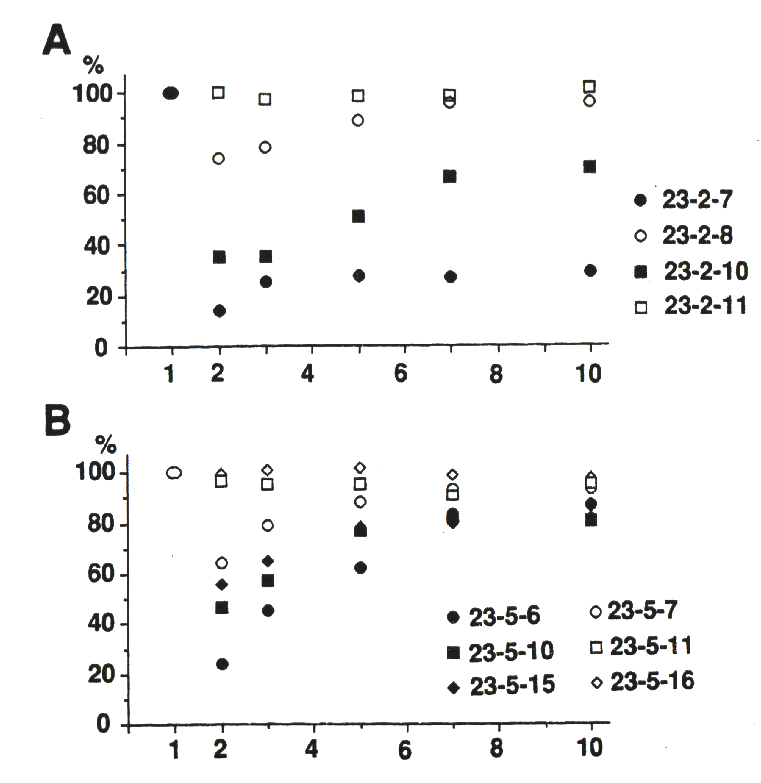
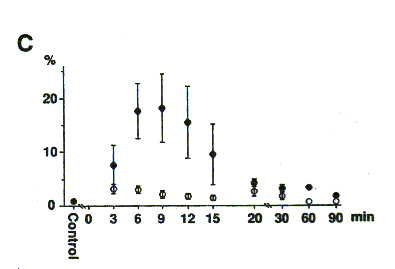
インパルス伝達のリサイクル過程が、終末に与えた刺激によって活性化され、それが短期記憶的に調節された。ウレタンで麻酔したラットを用いて、この現象を確認した。図A,Bに2つの代表例を示した。例えば、○ 23-2-8 は、個体 23-2でネオスチグミン投与後8分に記録したことを表す。投与後はじめて、あるいは2~4分の休憩を挟んで、0.5Hzで10コの刺激を与えると、2コ目に大きく抑圧され、ゆっくり回復した。ところが、1分の休憩では、10コの筋電位での変動は小さくなった。刺激によるリサイクル過程の活性化が、しばらく保持されたのだろう。そこで、誘発筋電位の振幅値の変動を、連続的な刺激条件下で調べた。0.5Hzで、間欠的および連続的に刺激を与え、ネオスチグミン投与後の時間を横軸に、ある時点で10コの筋電位からえられる変動係数を、図Cにプロットした。投与前および、投与後20分も経過すれば、いずれの刺激条件下でも、変動係数は非常に小さい。しかも、連続的な刺激条件下では、どの時点でも小さい値であった。インパルス伝達のリサイクル過程が、短期記憶的に調節され、連続的に刺激を与えたとき、活性化の効果が累積され、インパルス伝達が安定化したと考えられる。
視神経再生に対する光遮断飼育の影響
渡部眞三、犬養尚子
[背景]哺乳動物の中枢神経細胞の軸索は、切断されたら再生することなく、最終的には軸索だけでなくその細胞体も変性して死滅する(逆行性変性)。網膜神経節細胞は中枢神経系に属するので、その軸索である視神経が切断されると同様に変性する。しかし、末梢神経をその断端に自家移植することによって、視神経が再生することが明らかになっている。[目的]末梢神経移植による視神経再生が、光がほとんどない条件下で飼育した場合、どのようになるかを調べた。[方法]麻酔下で成ネコの左視神経を切断し、断端に坐骨神経前枝を自家移植し、移植神経の他端を側頭筋内に入れた。1頭は12時間蛍光灯の照明(200-250ルクス)、12時間暗やみ、の条件で飼育し、2頭はケージ清掃の時に10分間250ルクス、その時間以外は暗やみ(0.02ルクス以下)で飼育した。約60日後に移植神経に赤色の蛍光色素を注入して、軸索を再生した神経節細胞を標識し、2日後にネコを深麻酔して網膜を取り出し、培養液を循環したチェンバー内で、黄色の蛍光色素、ルシファ・イエローを細胞内に注入した。[結果]1.標識された細胞の密度:暗やみ飼育下の1頭の網膜で標識細胞の密度が低かったが、他の正 常および暗やみ飼育下の各1頭の網膜では密度の差はなかった。このことから視神経の再生は、光がなくても影響がないと結論できる。2.細胞内注入法による標識細胞の形態:暗やみで飼育した2頭の網膜とも、注入したすべての標識神経節細胞において病的な像が見られた。具体的には、細胞体や樹状突起に空胞があるもの、変性したもの、などであった。[考察]以上の結果から次の可能性が考えられる。1)軸索再生中に網膜外層からの神経信号を欠くか乏しい場合、軸索を切断された神経節細胞は病的な状態になる。2)長時間の暗やみ飼育と短時間の露光は、軸索を切断された神経節細胞に過大のストレスを与え、損傷を生じている。3)色素を移植神経に注入するとき再生した軸索を傷つけているが、この損傷によって致命的なダメージを受けるほど、暗やみで軸索を再生している神経節細胞は弱い。以上の可能性のいずれであるかを確かめる実験を実施する予定である。
視神経切断後残存しているネコ網膜内軸索の直径分布
犬養尚子,渡部眞三
ネコの網膜神経節細胞は,細胞体の大きさと軸索の直径が異なる3つのタイプ(アルファ細胞,べータ細胞,その他の細胞)に大きく分類される。これらのタイプの間で視神経切断2ヵ月後に生存する割合が異なることも報告されている。軸索切断後に生存している網膜内視神経の直径を計測して,ネコ網膜神経節細胞のそれぞれのタイプにおける,軸索切断に対する抵抗性の違いが短期間でもあるかどうか調べた。視神経切断して1週間後と2週間後に網膜を固定し,視神経乳頭から1mm離れた網膜の4カ所(鼻側,側頭側,背側,腹側)をエポンに包埋した。それぞれの部位の網膜内線維を電顕で撮影し,写真上で生存している軸索の直径を計測した。その結果,正常な網膜ではほとんどの部位において,小型径と中程度径に一つのピークと大型径に長い尾を持つ一峰性,鼻側網膜では小型径と中程度径にそれぞれピークを持つ二峰性の,軸索直径分布のヒストグラムが得られた。切断1週間後では,鼻側で中程度の径の軸索の割合の減少が認められた。また,切断2週間後では,鼻側,腹側で中程度径の軸索の割合の著しい減少,側頭側で小型径の軸索の割合の減少,及び全ての部位で大型の径の軸索の 割合の増加が認められた。一方、切断後7日目までと,8日目から14日目までの軸索の減少率は,それぞれ4.0%,2.6%(平均)であった。これらの結果から,短期間での視神経切断に対する抵抗性も,中程度径の軸索を持つ神経節細胞(ベータ細胞に相当)で低く,大きな直径の軸索を持つ神経節細胞で高いことがわかった。そして網膜内線維の減少率が,視神経切断後7日以前と7日以後とで異なることがわかった。
軸索を切断された網膜神経節細胞の末梢神経架橋による長期生存
渡部眞三、犬養尚子、福田 淳1
[目的]軸索(視神経)を切断された網膜神経節細胞の逆行性変性は、断端に末梢神経を移植して軸索を再生させることで免れるが、再生した視神経の終末が中枢神経細胞とシナプスを形成しなければ、最終的には死滅する。成ネコの視神経の切断端と中枢神経組織との間を末梢神経を移植して架橋することによって、軸索を切断された神経節細胞の100日以上の生存を試みた。[方法]麻酔下で切断した左視神経の断端に坐骨神経前枝を自家移植し、移植神経の他端(中枢端)を前頭葉皮質、頭頂葉皮質、視覚領野皮質、あるいは外側膝状体へ接続した。111-175日後、移植末梢神経に蛍光色素を注入して2日後に灌流固定し、逆行性標識された神経節細胞の数と分布を調べた。移植神経中枢端の位置は脳の凍結切片から調べた。[結果]移植神経の中枢端:移植神経の中枢端は、前頭葉皮質(1例)、頭頂葉皮質(1例)、視覚領皮質(3例)、外側膝状体(3例)、白質(4例)に接続され、1例で移植神経が消失していた(表1)。生存神経節細胞の数:移植神経の中枢端が大脳皮質に接続された場合と外側膝状体に挿入された場合にのみ、多数の神経節細胞の生存が確認された。さらに、外側膝状体に 移植神経の中枢端が存在していた#53で、標識神経節細胞の数が特に多かった。移植神経端が白質に挿入されていた4例の網膜において、神経節細胞の生存はほろんど認められなかった(表1)。生存神経節細胞の樹状突起の形態:外側膝状体に架橋して143日後の網膜(#43)の、神経節細胞の樹状突起の形態を蛍光色素の細胞内注入法で調べたところ、アルファ細胞およびベータ細胞の樹状突起の形態は、正常のものとあまり変わらなかった。[結論]軸索を切断された網膜神経節細胞は、網膜からの直接投射のない大脳皮質のニューロンとシナプスを形成する可能性があり、その結果長期間生存する。本来投射しているLGNへ接続した場合に、生存細胞の数が最も多かった。これは同側の網膜の入力が欠如して外側膝状体のニューロンに、シナプスを形成する空所が新たに生じたためと考えられる。
1大阪大・医・第二生理
表1.移植末梢神経の中枢端の位置と生存していた網膜神経節細胞の数
| 実験番号 | 移植神経中枢端の位置 | 生存日数 | 神経節細胞の総数 |
|---|---|---|---|
| 35 | 白質+ | 113 | 0 |
| 36 | 白質1 | 157 | 0 |
| 37 | 白質1 | 131 | 18 |
| 38 | 灰白質2 | 131 | 630 |
| 42 | 灰白質3+白質4 | 137 | 237 |
| 44 | 白質4 | 166 | 0 |
| 46 | 白質4 | 141 | 31 |
| 48 | 視覚領 | 149 | 609 |
| 49 | 視覚領 | 136 | 1 |
| 50 | 視覚領 | 150 | 337 |
| 51 | 外側膝状体 | 115 | 854 |
| 53 | 外側膝状体 | 148 | 2136 |
| 67 | 外側膝状体 | 177 | 402 |
略号:+,移植神経が消失;1,前頭葉の白質;2,前頭葉の灰白質;3,頭頂葉の灰白質;4,頭頂葉の白質
移植末梢神経の架橋によるネコ網膜-膝状体視覚領路の再構築の可能性
渡部眞三、三好智満1、犬養尚子、福田 淳1
[目的]視神経の断端と外側膝状体に末梢神経を移植して架橋した、前の研究報告の実験例のうち、移植が成功したと思われる2例(#53、#67)における、視覚領での光誘発電位を測り、網膜-膝状体-視覚領路の再構築の可能性を検討した。[方法]前の研究報告の実験で、赤色の蛍光色素を移植神経に注入する前に、眼前においたフラッシュ光で誘発される電位を視覚領で記録し、100回以上の記録を加算平均した。光誘発電位は、末梢神経を移植した眼と健常眼を刺激して記録し、健常眼の視神経を切断して移植眼からの誘発電位のみを記録した。両眼刺激では健常眼優位と見なした。[結果]#53の移植眼のみの刺激では、30-150ミリ秒に緩やかな陰性の光誘発電位が、耳孔から前方1mmの視覚領で認められた。電圧は10.5μVで、健常眼刺激の70μVと比較して小さかった。また#67では40-120ミリ秒に16μVの陽性の光誘発電位が、耳孔から後方1mmの視覚領で生じた。健常眼刺激では28μVの陽性電位が記録された。[結論]再生視神経終末と外側膝状体のニューロンとシナプスが形成され、網膜-膝状体視覚領路が再形成されたかどうかは、これらの結果だけからは明らかでない。しかし低い値では あるが、健常眼刺激の場合の誘発電位に近い値の誘発電位が視覚領から記録されたことは、外側膝状体においてシナプスが形成され、視覚領へ光情報が伝達されたことを示唆している。
1大阪大・医・第二生理
筋ジストロフィー症DMD患者とdyマウスの発症のタイミングは一致する
戸塚 武
Duchenne型筋ジストロフィー症(DMD)患者とモデル動物のdyマウスの病態は、筋病変だけでなく、発育につれて病状が容赦なく進行する点などもよく似ている。ただ、ヒトとマウスでは症状の比較が難しく、症状とその進行・悪化がどのように似ているかは不明であった。本研究で初めて、両疾患の発症のタイミングが一致する(骨あるいは身長の相対的急成長期の終り頃にあたる)ことがわかった。これは、dyマウスの発症機構に関する私たちの筋成長障害説(一歩進めた筋-骨不均衡説)がDMDにもあてはまる可能性が高いことを示唆している。
正常雄マウスについて、体重(W)を脛骨長(L)の3乗値で割った値(W/L3)の発育との関係を調べたところ、生後すぐから急速に減少し、16,17日齢頃以降ほぼ落着くことがわかった。dyマウスの発症は14日齢頃で、正常マウスでW/L3値の落着く直前(骨の相対的急成長期の終り頃)にあたる。
健常男子について、体重(W)を身長(L)の3乗値で割った値(W/L3)の発育との関係を調べたところ、生後すぐから急速に減少し、6,7歳頃以降ほぼ落着いた。DMD患者の発症は5歳頃とされ、健常男子でW/L3値が落着く直前(身長の相対的急成長期の終り頃)にあたる。体重と身長の値は、厚生省「国民の栄養調査報告書(1993)」中の各年齢の平均値を使った。
10年前、DMDの責任遺伝子による産物蛋白質としてジストロフィンが予言されて以来、DMDの相同遺伝子の異常による疾患モデル動物とされるmdxマウスが重用されるようになり、国内外ともにdyマウスの研究は下火になった。ところが最近、当初から分かっていたことではあるがDMDとmdxの病態が顕著に異なることに疑問を抱く研究者が増え、再びdyマウスが注目されるようになった。例えば、フランスのLucas-Heronは、私たちとは別の観点から、dyマウスがDMD研究に非常に適したモデル動物であることを提示した。遺伝子研究の進歩により、筋ジストロフィー症(MD)はじきに解明されるだろうと一般に期待されているが、実は、専門家の間では、かえって混沌としてきたかもしれない(Dubowitz, 1997)との思いが広がっている。DMD遺伝子に異常がありながらMD症状がない例が次々と(逆は無数?)報告されている。早くから気付かれていたことではあるが、ジストロフィンの遺伝相談がいろいろな意味で危ないことが、最近、あらためて警告されている。
本研究は、愛知県特定疾患研究協議会依託研究費の援助を受けた。
筋ジストロフィー症の病態の見直し:中心核筋線維はむしろ太い
戸塚 武
正常筋の細胞(多核の線維状をした細胞体で筋線維と呼ばれる)では、ほとんどの核が細胞周縁部に局在する。ところが、筋ジストロフィー症(MD)に罹患した筋では、細胞内部に核を持つ筋線維が目立つようになる。中心核筋線維と呼ばれるこのような筋線維は、変性した筋線維に代わる再生不全の筋線維である(通説)と一般に考えられてきた。しかし、不思議なことに、中心核筋線維は再生不全を想わせる特徴を必ずしも示さない、すなわち、細くもないし、未熟でもないことを明らかにしてきた。このことは、古く(1963)、Harmanたちがはっきり記述しているけれど、ほとんど忘れ去られてしまっている。中心核はMD筋に特異的というわけではなく、各種筋疾患で見られる。多くの研究者が、自分が提示している写真の中に、太い中心核筋線維が写っていることに気付いていない。
中心核の意味を明らかにすることは、MD筋病態の理解に重要であると思われるが、未だに不明のままである。先入観を捨て、客観的にMD筋の病態を見直してきたつもりであった私たちも、実は、通説に対して反論することに捕らわれていたことに最近気付いた。すなわち、中心核筋線維は、細くないのではなく、むしろ太いことがわかった。
病状の比較的落ち着いた成獣mdxマウスの筋の凍結横断切片(ヘマトキシリン染色)の顕微鏡写真で、コンピュータに接続したディジタイザを使って筋線維横断面積を計測し、太さ頻度分析をしたところ、中心核筋線維が無中心核筋線維より太い傾向にあることがはっきりした。dyマウスの筋でも同様の傾向が認められた。ヒトMD筋ではどうであろうか。有名なErbの描いたMD患者の筋の横断像(1891)を分析したところ、中心核を持った筋線維は明らかに太いことが分かった。中心核を持った筋線維が太くなったのか、太い筋線維に中心核が出現したのか(原因か結果か)は不明である。
「中心核は活性化された状態にある」という作業仮説(Totsukaたち、1993)を実証するのが、今後の研究課題の一つである。この作業仮説は新しい考えとして紹介されている(SchulerとPette、1996)。
本研究は、愛知県特定疾患研究協議会依託研究費の援助を受けた。
筋ジストロフィー症mdxマウスと正常ウズラ;成長と中心核筋線維
戸塚 武、渡辺貴美、佐久間邦弘、浦本 勲
ほ乳類の筋線維の核は、普通は細胞周縁部に局在(周縁核)するが、病的状態(主に筋の変性または炎症性疾患)になると、しばしば細胞内部に見られる(中心核)ようになる。ところが、鳥類の筋では正常筋線維に普通に中心核が見られることは広く知られている。
私たちは、中心核がどのような生理的意味をもつのかを明らかにするための研究の一つとして、成長との関連を検討してきた。そして、mdxマウスの筋で、中心核が、生後30日齢頃まではあまり見られないのに、それ以後急に、普通の太さの筋線維に目立つようになること、dyマウスでも似た現象が見られることを明らかにした。本研究でさらに、正常ウズラの筋においても同じような現象が起こっていることを確認した。
あまり知られていないのではないかと思われるが、孵化(ふか)後15日齡頃の正常ウズラの筋では中心核はあまり目立たないことがわかった。その後30日齢頃にかけて普通の太さの筋線維に中心核が目立つようになり、発育につれて中心核の頻度は(筋線維横断面あたりの数も)さらに増加した。因みに、あたかも内部へ移動し始めたような周縁核をしばしば観察した。おもしろいことに、MD筋と同様に、ウズラの筋でも、中心核を持った筋線維は、持たない筋線維より明らかに太めであった。中心核は筋成長と関係がありそうで、「中心核は活性化された状態にある」、あるいは、「中心核を持った筋線維は比較的よく成長する」という考えは正しいであろうと推察される。ただ、中心核の出現が分裂によるもので、核の数が増加したため中心核筋線維の成長が促進された可能性も捨てきれない。因みに、生後の筋成長は核の分裂・増加を伴わないと言われてきたが、最近、Mozdziakたちは、孵化後の七面鳥の筋成長に、筋核の増加が関係しているらしいと報告している。
中心核は、筋細胞が生理的な要請を受け(例えば引き伸ばされたことを感知して)、周縁核が内部に移動したものか、それとも、見えない核が顕在化したものか、また、そのような核の変化が細胞膜、細胞骨格や細胞内膜などとのどのような相互作用による結果なのか、それによって核の機能がどのように変化するのか、興味深い課題である。
本研究は、愛知県特定疾患研究協議会依託研究費の援助を受けた。
筋ジストロフィー症dyマウス:筋核の皺(しわ)と陥没
渡辺貴美、長浜真人1、戸塚 武
dyマウスの筋成長障害は、骨成長依存性筋成長障害によるという作業仮説を提唱してきた。すなわち、成長する骨による引き伸ばし刺激に対する筋の感応機構に異常があるのではないだろうかと考えている。このような機構と、それを担う機械-化学(機械的刺激→化学反応)変換器が実在するのか、また、あるとすればどのようなものなのか、全く不明である。
私たちは、光学顕微鏡と電子顕微鏡による研究から、筋核が変容する(形、連鎖状連結、細胞内の位置など)こと、dy筋核は正常筋核に比べて雛が多いらしいことを明らかにした。核が様々に変形することは、単細胞の場合だけでなく、種々の組織細胞でも知られているが、その機構や意味を追究した研究はあまり無いようである。古く(1973)、Franzini-Armstrongは、核の雛の深浅が筋の伸縮状態と関係あるらしいと記述している。それらのことから、今のところ私たちは、筋核が機械-化学変換器として働いているのではないかと考えている。さて、罹患筋では時として筋線維の核に陥没が見られることが知られている。そこで今回核の陥没像に注目して、dy筋と正常筋を比較検討した。
dy筋の超薄切片の電子顕微鏡写真で、核に確かに陥没らしい像、すなわち、核膜から離れた内部に核膜の内外が反転したような膜で囲まれた楕円形の穴(穴の内部には細胞質がつまっているように見える)が観察された。ところが、正常筋の核でも同様に陥没像が観察された。dy筋と正常筋で核の陥没の程度や頻度に差異があるかどうかは今のところ不明である。
核の皺や陥没は、核に全体的、あるいは局所的に圧力や張力がかかっていることを示している。それが核と細胞の間のどのような相互作用によるのか、核の機能にどのような影響を与えているのか、最近盛んになってきた核膜の骨格構造、核の内部構造、核を取り巻く細胞環境などの研究とも関連して、興味深い。
1形態学部
筋ジストロフィー症dyマウス:径の小さい筋線維は、未分化なタイプではない
佐久間邦弘、渡辺貴美、浦本 勲、戸塚 武
筋ジストロフィー症のモデル動物であるdyマウスの筋では、筋線維径の大小不同がみられる。dy筋において異常に肥大した筋線維は、変性する運命にある膨潤したものであり、逆に小さい線維は再生不全の状態にあるとこれまで考えられてきた。もしその仮説が正しいならば、dy筋には、径が極端に小さく未分化なtype ⅡC線維が多く存在するはずである。本研究では、上記の仮説の可否を検証することを目的とした。
生後2,6,12週齢のヒラメ筋から得られた8μmの連続横断切片に2種類のmyosin ATPase染色とNADHase染色を施し、筋線維の大きさの分布を正常な筋とdy筋で比較検討した。2週齢では両群のtype Ⅰ、 Ⅱ線維の大きさの分布に有意な差はみられなかったが、6および12週齢ではdy筋の大小不同が顕著になった。また正常な筋では、発育にともない筋線維が大きくなる傾向がみられたが、dy筋では6週齢以降に大きさの変化は認められなかった。dy筋における径の小さい筋線維には未分化なtype ⅡCタイプはほとんど観察されず、その大部分が成熟したtype Ⅰ、ⅡAタイプのものであった。
したがってdy筋における筋線維の大小不同は、変性-再生の結果によるものではないと思われる。
筋ジストロフィー症dyマウスにおける低分子量ストレス蛋白質の発現変化
佐久間邦弘、渡辺貴美、戸塚 武、加藤兼房1
筋肉中の酸化ストレスおよびフリーラジカルの発現が異常に亢進することが、Duchenne型筋ジストロフィー(DMD)の症状を説明する可能性の1つとして考えられている。実際にBrownmanは、DMD患者の筋においてHeat Shock Protein(HSP〕90およびubiquitinの発現量が増加することを報告しているが、それ以外に筋ジストロフィーとHSPの関係について扱った研究は認められない。本研究では、先天性筋ジストロフィー症のモデル動物と考えられているdyマウスを用いて、3種類の低分子量HSP(αB crystallin、HSP 27、p20)の発現を正常マウスと比較検討した。
イムノアッセイ法、ウエスタンブロット法の両方の結果から、正常マウスの低分子量HSPは、速筋よりも遅筋に明らかに多く存在した。速筋タイプの前脛骨筋では、dyマウスの低分子量HSPの発現量は正常マウスよりも有意に高値を示した。一方、遅筋タイプのヒラメ筋においては、dyマウスの発現量は正常マウスよりも低値を示した。またウエスタンブロット法を用いて、高分子量のHSP 70について調べたところ、ヒラメ筋、前脛骨筋とも両群の発現量に有意な差は認められなかった。
以上のことから、dyマウスの速筋においては低分子量のストレス蛋白質が特異的に増加することが明らかになった。現在免疫組織染色に取り掛かっており、イムノアッセイ、ウエスタンブロットの結果と同様、p20の発現の亢進がdyマウスの前脛骨筋で観察されている。
1生化学部
行動奇形学共同研究〔日本〕の結果-その3-
出生日を行動発達テストの基準にすることによる結果の誤った解釈
橘 敏明、Behavioral Teratology懇話会18施設
SD系ラットを用い、妊娠7-20日にニコチン6mg/㎏/BW/dayを腹腔内に注射し、出生仔に対して、体重、複数の身体発達の項目、いくつかの行動テストでニコチンの影響を調べた。対照群には生理食塩水を注射した。その結果、いくつかの指標でニコチンが出生仔の発達を促進するという奇妙な結果を得た。しかもニコチンは妊娠日数を延長させることがわかった。
ところで行動奇形学の分野では出生日を基準にして発達テストを実施するのが一般的である。本研究でも、この方法にもとづいてテストを実施した。しかし妊娠日数に違いがある場合、出生日を基準とした同一日にテストをしても、ニコチン群は受精日からみると対照群より年長である。このためにニコチン群の発達の遅れを過小評価してしまう可能性が出てくる。
出生日を基準としたテストをすでに実施してしまっている。そこで、妊娠日数の違いを考慮して、受精日からみて対照群と同一の日にテストをすれば、このようになるであろうというニコチン群の推定値を共分散分析の手法を利用して計算した。こうして得たニコチン群の推定値と対照群の結果を比較すると、ニコチンが出生仔の発達を促進するという奇妙な結果はことごとく消えた。このことは従来の方法で見つけたニコチンの発達促進の効果は、誤った分析方法の産物であると考えられる。さらに、従来の方法では影響がなかった指標で、新たな影響を見つけた。このことは従来の方法に従うとその影響を見逃してしまう指標がある可能性を示している。
各国の薬事行政に強い影響力のあるICH(日・米・EU三極新医薬品承認審査ハーモナイゼーション国際会議)の生殖試験のガイドラインでは出生日を標準的な基準として推薦していること、行動奇形学関係の雑誌でも出生日を基準にすることが一般的であること、さらに妊娠を延長させる薬物がすでにいくつか見つかっており、これが特殊な現象ではないこと、これらのことを考えると、われわれの得た結果は重要な意味をもっていると考える。
タッチスクリーンを用いたラット行動テストの可能性の検討
岡 博子、橘 敏明
タッチスクリーンによってモニタ画面そのものがスイッチの機能を持ち、固定した状態の視覚刺激に移動等の動きを加えることが可能となった。既にハトやサル等でこれを用いた研究が行なわれている。しかしラットによる研究はほとんどない。そこで我々は、ラットでタッチスクリーンを使用した行動テストの可能性を検討することにした。なお、外部機器はパソコンで制御した。
DA系ラットの雄4匹を用い、1ヵ月齢からテストを開始した。テストは約20時間飲水制限下で実施した。1回の正答につき約0.028mlの水を与えた。テストは1セッション30分で、1日2セッションを実施した。
まず単純な学習から始めた。2匹のラットには、モニタ画面に90mm×68mmの白い長方形を表示し、タッチスクリーンを通してその内側の領域を押すと正答、それ以外を誤答とした。約2週間このセッションを実施したが、正答率は最高で各々79.0%、75.3%であった。このことから、ラットにターゲットのみを正確に押すことを要求するのは難しいことが分かった。他の2匹は、黒および白の同じ大きさの2つの円(直径60mm)をモニタ画面に水平に表示し、一方の図形を押すと正答、他方を誤答とした。このとき、図形以外の部分を押した場合には試行は終了しないことにした。約3週間テストを行なった結果、2匹とも90%近い正答率を示した。これらの結果から、DA系ラットでタッチスクリーンによる弁別学習が可能であることを確認した。ついで、視覚刺激を変更し、いくつかの学習パラダイムをテストした。そのうちのmatching-to-sampleによるテストで困難にぶつかった。
このテストは、水平に並べた3つの図形を表示し、中央のサンプル図形と同じものを左右の図形から選択すると正答とした。約3ヵ月間続けたが、4匹の正答率は60%前後にとどまった。なぜ正答率が上昇しなかったかについては現在検討中である。
今後はDA系ラット以外の有色の系統を用いて、タッチスクリーンによる行動テストの可能性を追求していく予定である。
自発放電するラット培養大脳皮質ニューロンの神経突起の長さの計測
中西圭子、久木田文夫1
ラット大脳皮質ニューロンを長期培養し、任意の2つのニューロンの膜電位活動を同時記録したところ、これらのニューロンの膜電位も同期して頻回放電(以下、burst)していることがわかった。このburstの機序を解析するための基礎研究として、ニューロンの細胞内にギャップ結合を通過しうる低分子量色素(Lucifer Yellow)を注入し、その広がりからギャップ結合の有無および神経突起の長さを計測した。
培養11-16日後、周期的にburstを繰り返しているニューロンの細胞内にパッチ電極を介して、Lucifer Yellowを注入した。注入した9個のニューロンのうち、どの細胞においても、隣接するニューロンおよびアストロサイトヘの色素移行は認められなかった。また同期してburstしているニューロン間で、一方のニューロンを過分極通電したところ、他方のニューロンの応答は観察されず、これらの細胞間での電気的シナプスによる連絡は否定的であった。これらのことから、ニューロン間のburstは電気シナプス以外の連絡によっておこっていると推測された。
また、注入したLucifer Yellowの蛍光写真から、神経突起の長さを測定した。細胞体の中心から最も長い突起の先端までの直線距離を最大神経突起長、最も短い突起の先端までの直線距離を最小神経突起長とし、測定した。最大神経突起長は、188.4±15.4μm、また最小神経突起長は、52.2±4.3μmであった。この結果から、我々の培養系では、ひとつのニューロンは半径約200μmの範囲で、神経突起を伸ばしていることがわかった。
これらの基礎研究をふまえて、発達期のニューロンの初期のネットワーク形成と思われるニューロン間の同期したburstの解析を行い、さらに脳神経発達障害の機序を探求していく予定である。
1岡崎生理研・生体膜
小頭症ラットの大脳皮質:ラット体性感覚野ニューロンの形と反応の自動解析
伊藤宗之、加藤美幸1、川端優男1
(目的)ラットの脳には樽構造(バレル)と呼ばれる、群塊が顔面のひげの本数だけ毛根の並び具合に合わせて現われる。感覚領に脳地図が目に見える稀な場合で、感覚発達の指標として注目される。正常ならば大脳皮質体性感覚野第4層に現われるはずのバレルは、胎生期にX腺照射を受けて育った小頭症ラットには現われない。大脳皮質を構成する二種類の神経細胞、大きい錐体ニューロンと小さい星状ニューロンの内,後者が障害を受けやすいため、これらを構成要素とするバレル欠落のモデル動物ができる。感覚の障害は計りにくいので、残存する錐体ニューロンのひげ振れ刺激に対する感受性を正常と比較して、星状ニューロンの本来の役割を推測してきた。(方法)胎生17日に母体壁を通し200rのX線照射ののち生まれ育ったラットをウレタン麻酔下で行なった。今回、ひげ刺激によるインパルス反応を自動的に評価する機械を作製したので、改めてX線小頭症ラットの錐体ニューロンのスパイク放電を細胞外記録した。一方、細胞内記録は昨年度に引きつづき錐体ニューロンで行ない、細胞内染色と組み合わせ、小頭症ラットでの尖頭樹状突起の早期の二分岐を調べた。大脳皮質内の誘発電位層状 解析を行った。(結果と考察)錐体ニューロンから表層に向かう突起の異常分岐は早くおこるほど(細胞体から分岐までの距離の短いほど)、分岐の角度が大きいことを確認した。また層状解析では錐体ニューロン層のスパイク放電は皮質表層に伝わらない間接証拠を得た。細胞体から表層に(逆行性に)向かう活動は、分岐の点で伝導が止るのだと考えた。しかし、今回のインパルス測定で小頭症と正常ラットの間に基本的な違いがなかったので、末梢から細胞体にスパイク放電が伝わるまでは、分岐は影響しないと考えた。今後はまず正常ラットのバレル内で星状ニューロンの反応測定を行なう。単離したニューロンの突起で興奮伝導が分岐を越えられるか調べたい。
本研究の発表に際し、大幸財団の援助を受けた。
1共同研究科
ひげ刺激とニューロン反応測定のためのハードウェアとソフトウェア
伊藤宗之
(目的)ニューロン反応の定量的解析には増幅器以外、信号処理器と総称されるコンピュータ関連機器とそのプログラム(ソフトウェア)が必要である。これら市販品は汎用性があり、広い実験分野に設定を変えて対応できるが、汎用性にも限度があり実験者の特別の注文はかなえられない。高価でもある。脳障害モデル動物の大脳皮質体性感覚野のニューロン活動を記録しながら、顔面のひげに振れ刺激を与えて反応を記録しているが、刺激波形は定量的とはいえ、毎回の設定は手動であった。機械刺激の波型を変えつつ繰り返しながら、同時に神経インパルスを記録するひげ刺激器と専用プログラムを作製した。(ハードウェア)パソコン用に増設する入出力ボードを作製し、出力信号は簡単な変換器を介し、ガルバノメターを回し、ひげを変位させる。ニューロンのスパイク放電は1ミリ秒のパルスに変換し入力信号とする。(ソフトウェア)刺激出力とデータ取り込みにはマシン語、表示にはべ一シック言語でコンピュータ8086をプログラムした。一つのポートを使い1ミリ秒毎に、台形波になるよう出力を上げ、他のポートで神経パルスの有無を検する。有ならメモリーに加算する。一波形(2560ミ リ秒)終われば、波形を変えて刺激する。20種の波形を一巡する(1セット)と20個のグラフを並べる。それぞれ横軸は時間で2560ミリ秒、縦軸は累積インパルス数である。最大100セットくりかえすが、図示はセットごと更新する。ひげの変位は5種の立ち上がり速度(100-5mm/s)のそれぞれに4種の振幅(2000-200μm)を組み合わせた。
研究業績
著書・総説
渡部眞三:末梢神経自家移植による視神経再生とその結果-形態学的検証-眼科 New Insight 9:190-197, 1996.
大出尚郎1,佐々木仁2,三好智満2,渡部眞三,福田淳2(1慶應義塾大,2大阪大):網膜・視神経の機能再建.神経進歩40(5):823-834, 1996.
Fukuda, Y.1, Watanabe, M. (1Osaka Univ.): Regeneration of cat's optic nerve and its functional recovery.Rev Brasil.Biol 56(Suppl.1):69-78, 1996.
福田淳1,渡部眞三,澤井元2,佐々木仁1,井上徹2,三好智満1(1大阪大、2岡山県立大):末梢神経移植による視神経の再生と視覚路の機能再建,神経の再生と機能再建-基礎と臨床-,志水義房他編,西村書店,pp. 273-287. 1997.
原著論文
Kawamura, N., Seto-Ohshima, A., Ito, M.: Computer-assisted three-dimensional reconstruction of the vestibular end-organs of teh gerbil using the serial paraffin sections. Acta Histochem. Cytochem. 30:55-58, 1997.
Yamashita, T.1, Ohshima, H.1, Asanuma, T.1, Inukai, N., Miyoshi, I.2, Kasai, N.2, Kon, Y.1, Watanabe, T.1, Sato, F.1, Kuwabara, M.1 (1Hokkaido Univ., 2Tohoku Univ.): The effect of α-phenyl-tert-butyl nitrone (PBN) on copper-induced rat fulminant hepatitis with jaundice. Free Radic. Biol. Med. 21:755-761, 1996.
Watanabe, M., Fukuda, Y.1 (1Osaka Univ.): Proportions of ON-center versus OFF-center cells in retinal ganglion cells with regenerated axons of adult cats. Exp. Neurol. 143:117-123, 1997.
Mizutani, T.1, Tanabe, K.1, Watanabe, K., Goto,M.2 (1Nagoya City Univ., 2Kumamoto Univ.): Se1enium contents in Astragalus and uncultivated soils in Japan. Jpn.J. Toxicol. Environmental Health 42:360-366, 1996.
Sakuma, K., Saitoh, Y.1, Katsuta, S.2 (1Ibaraki Pref. Univ. Health Sci., 2Tsukuba Univ.): Denervation-induced region-specific changes in fibre types in the soleus and plantaris muscles of rats. Acta Neuropath. 93:129-135, 1997.
Yamaguchi, A.1, Sakuma, K., Morita I.1, Soya, H.2, Takeda, H.3, Katsuta, S.4 (1Health Sci. Univ. Hokkaido, 2Mie Univ., 3Sapporo Med.Univ., 4Tsukuba Univ.): Changes in fibre types in rat soleus and plantaris muscles following hypophysectomy and compensatory overload. Acta Physiol. Scand. 158:89-95, 1996.
Tachibana, T., Terada, Y.1, Fukunishi, K.2, Tanimura, T.3 (1Dainippon Pharmac., Ltd., 2Kanebo Ltd., 3Kinki Univ.) : Estimated magnitude of behavioral effects of phenytoin in rats and its reproducibility: A collaborative behavioral teratology study in Japan. Physiol. Behav. 60:941-952, 1996.
Tachibana, T., Yokoo, A., Yoshino, H.1 (1Toyo Sangyo Co., Ltd.): Case of Sprague-Dawley rats which did not respond to an 'alarm substance’in the forced swimming test.Psycol.Rep. 79:1007-1018, 1996.
Isobe, I.1, Watanabe, T.1, Yotsuyanagi, T.1, Hazemoto, N.1,Yamagata, K.2, Ueki, T.1, Nakanishi, K., Asai, K.1, Kato, T.1 (1Nagoya City Univ., 2Sumitomo Metal Industries): Astrocytic contribution to blood-brain barrier formation of endothelial cells: a possible use of aortic endothelial cell for in vitro BBB model. Neurochem. Int. 28:523-533, 1996.
その他の印刷物
戸塚 武:心配なジストロフィンの遺伝相談.病理と臨床 14:1442, 1996.
戸塚 武,渡辺貴美,浦本 勲:筋ジストロフィー症dyマウス:骨成長依存性筋成長障害と皺む筋核.愛知県特定疾患研究協議会,平成7年度研究報告書,133,1996.
戸塚 武:筋ジストロフィー症の筋炎:幻のジストロフィン,医学界新聞 2218:4. 1996.
学会およびシンポジウム発表
浦本勲,渡辺貴美,戸塚武:誘発筋電位からみたインパルス伝達のリサイクル過程-短期記憶による調節?日本生理学会(福井)1996.4.3.
戸塚 武,渡辺貴美,浦本 勲:筋ジストロフィー症dyマウス:骨成長依存性筋成長障害と筋核のしわ.日本生理学会(福井) 1996.4.3.
渡部眞三,大出尚郎1,三好智満2,犬養尚子,福田淳2(1慶應義塾大、2大阪大):軸索を切断されたネコ網膜神経節細胞の末梢神経移植による長期生存.日本生理学会(福井)1996.4.4.
Ohde, H.1, Miyoshi, T.2, Watanabe, M., Fukuda, Y.2,Oguchi ,Y.1 (1Keio Univ., 2Osaka Univ.): Sciatic nerve grafting rescues the changes in pattern electroretinograms (PERG) after optic nerve section in adult cats. ARVO (Fort Lauderdale, USA) 1996.4.22.
浦本 勲,宮本謙一郎1,渡辺貴美,戸塚 武(1国立水俣病研):インパルス伝達のリサイクル過程に見られる短期記憶的調節.日本脳科学会(東京)1996.5.18.
渡部眞三,大出尚郎1,三好智満2,小口芳久1,福田淳2(1慶應義塾大、2大阪大):移植末梢神経の架橋によるネコ網膜視神経細胞の軸索再生と長期生存.日本神経科学会(神戸)1996.7.11.
中西圭子,Byrne J. H.1 (1Univ. Texas): Role Of Ca2+/CaM dependent protein kinase Ⅱ in short-term synaptic facilitation in Aplysia. 日本神経科学会 (神戸)1996.7.12.
伊藤宗之:X線小頭症ラットの体性感覚領ニューロン.日本神経科学会(神戸)1996.7.12.
橘 敏明:BT共同研究-メタ分析・パワー分析による結果.日本先天異常学会(札幌)1996.7.27.
渡部眞三,大出尚郎1,三好智満2,犬養尚子,福田 淳2(1慶應義塾大、2大阪大):末梢神経移植によるネコ網膜視神経細胞の軸索再生:網膜-皮質路の形成.生理研視覚研究会(岡崎)1996.8.1.
戸塚 武:筋ジストロフィー症dyマウスとDMD患者の発症のタイミングは同じ.分子病理研究会・山中湖シンポジウム(山梨県南都留郡)1996.8.18.
藤田佳織1,中西圭子,植木孝俊2,浅井清文1,加藤泰治1(1名古屋市立大,2国立精神神経センター):Neuron-astrocyte共培養系でのNeuronal Ca2+ oscillationに対するgap-junction阻害剤の効果.日本神経化学会(横浜)1996.10.3.
戸塚 武:筋ジストロフィー症にステロイドが有効である理由.朝霧シンポジウム(山梨県西八代郡)1996.10.7.
戸塚 武,渡辺貴美,浦本 勲,佐久間邦弘:筋ジストロフィー症の不思議:筋病変がないのに発症するdyマウス.中部日本生理学会(岐阜)1996.10.25.
Ito, M., Kato., M., Kawabata, M: Premature bifurcation of the apical dendritic trunk of pyramidal neurons in the X-irradiated rat cortex. The Barrels Ⅸ Program (Washington D.C.) 1996.11.16.
戸塚 武,渡辺貴美,浦本 勲,水谷隆治1(1名古屋市立大):筋ジストロフィー症dyマウス-胸腺の成長障害と萎縮-.日本疾患モデル学会(東京)1996.11.22.
戸塚 武,渡辺貴美,浦本 勲:筋ジストロフィー症とストレッチング.運動生化学研究会(三重)1996.12.1.
Fukuda, Y.1, Watanabe, M., Miyoshi, T.1, Sawai, H.2 (1Osaka Univ., 2Okayama Pref. Univ.): Morphological and physiological properties of cats' retinal ganglion cells with regenerated axons. In: Symposium by Australian National University Research School of Biological Sciences, "The Retina receives and the cortex believes".(Canberra, Australia) 1997.1.29.
浦本 勲,宮本謙一郎1,渡辺貴美,戸塚 武(1国立水俣病研・臨床部):ネオスチグミン存在下における幼若ラットのインパルス伝達.日本脳科学会(宜野湾)1997.2.6.
犬養尚子,渡部眞三:視神経切断後残存しているネコ網膜内軸索線維の直径分布.日本生理学会(浜松)1997.3.27.
渡部眞三,犬養尚子,福田 淳1(1大阪大):移植末梢神経の架橋によるネコ網膜-膝状体経路の再構築.日本生理学会(浜松)1997.3.27.
戸塚 武,渡辺貴美,佐久間邦弘,浦本 勲:筋ジストロフィー症DMD患者とdyマウスの発症のタイミングは一致する.日本生理学会(浜松)1997.3.27.
佐久間邦弘,渡辺貴美,浦本 勲,戸塚 武:筋ジストロフィー症dyマウス:肥大筋線維も細い筋線維も同じ特徴を持つ.日本生理学会(浜松)1997.3.27.
講演など
橘 敏明:統計的検定の結果をどう解釈するか.ニューロ・オンコロジィの会(東京)1996.4.6.
渡部眞三:成熟哺乳動物の視神経の再生.名古屋大学ニューロクラブ,1996.6.7.
橘 敏明:統計的検定:自信をもって使う.名古屋・医・第一内科勉強会(名古屋)1996.7.19.
戸塚 武,渡辺貴美,佐久間邦弘,浦本 勲:筋ジストロフィー症DMD患者とdyマウスの発症のタイミングは一致する.文部省「生体運動」合同班会議(豊中)1997.1.6.
その他の研究活動
海外活動
伊藤宗之:The Barrels Ⅸ Programに出席、発表(アメリカ合衆国)1996.11.15~11.19.
教育活動
伊藤宗之:生理学(愛知県立総合看護専門学校)1996.4.1.~1997.3.31.
伊藤宗之:生理学(愛知県立春日井看護専門学校)1996.4.1.~1997.3.31.
渡部眞三:生理学(大阪大学医学部)1996.4.1.~1997.3.31.
橘 敏明:統計学(愛知県立春日井看護専門学校)1996.4.1.~1997.3.31.
主題:
発達障害研究所年報 第25号 No.2
23頁~49頁
発行者:
愛知県心身障害者コロニー発達障害研究所
発行年月:
1997年09月
文献に関する問い合わせ先:
愛知県心身障害者コロニー発達障害研究所
〒480-03 愛知県春日井市神屋町713-8
TEL.0568-88-0811 FAX0568-88-0829
